Тривиальные названия веществ. Тривиальные названия некоторых неорганических соединений Какое 2 название
Классификация неорганических веществ с примерами соединений
Теперь проанализируем представленную выше классификационную схему более детально.
Как мы видим, прежде всего все неорганические вещества делятся на простые и сложные :
Простыми веществами называют такие вещества, которые образованы атомами только одного химического элемента. Например, простыми веществами являются водород H 2 , кислород O 2 , железо Fe, углерод С и т.д.
Среди простых веществ различают металлы , неметаллы и благородные газы:
Металлы образованы химическими элементами, расположенными ниже диагонали бор-астат, а также всеми элементами, находящимися в побочных группах.
Благородные газы образованы химическими элементами VIIIA группы.
Неметаллы образованы соответственно химическими элементами, расположенными выше диагонали бор-астат, за исключением всех элементов побочных подгрупп и благородных газов, расположенных в VIIIA группе:
Названия простых веществ чаще всего совпадают с названиями химических элементов, атомами которых они образованы. Однако для многих химических элементов широко распространено такое явление, как аллотропия. Аллотропией называют явление, когда один химический элемент способен образовывать несколько простых веществ. Например, в случае химического элемента кислорода возможно существование молекулярных соединений с формулами O 2 и O 3 . Первое вещество принято называть кислородом так же, как и химический элемент, атомами которого оно образовано, а второе вещество (O 3) принято называть озоном. Под простым веществом углеродом может подразумеваться любая из его аллотропных модификаций, например, алмаз, графит или фуллерены. Под простым веществом фосфором могут пониматься такие его аллотропные модификации, как белый фосфор, красный фосфор, черный фосфор.
Сложные вещества
Сложными веществами называют вещества, образованные атомами двух или более химических элементов.
Так, например, сложными веществами являются аммиак NH 3 , серная кислота H 2 SO 4 , гашеная известь Ca(OH) 2 и бесчисленное множество других.
Среди сложных неорганических веществ выделяют 5 основных классов, а именно оксиды, основания, амфотерные гидроксиды, кислоты и соли:
Оксиды — сложные вещества, образованные двумя химическими элементами, один из которых кислород в степени окисления -2.
Общая формула оксидов может быть записана как Э x O y , где Э — символ какого-либо химического элемента.
Номенклатура оксидов
Название оксида химического элемента строится по принципу:
Например:
Fe 2 O 3 — оксид железа (III); CuO — оксид меди (II); N 2 O 5 — оксид азота (V)
Нередко можно встретить информацию о том, что в скобках указывается валентность элемента, однако же это не так. Так, например, степень окисления азота N 2 O 5 равна +5, а валентность, как это ни странно, равна четырем.
В случае, если химический элемент имеет единственную положительную степень окисления в соединениях, в таком случае степень окисления не указывается. Например:
Na 2 O — оксид натрия; H 2 O — оксид водорода; ZnO — оксид цинка.
Классификация оксидов
Оксиды по их способности образовывать соли при взаимодействии с кислотами или основаниями подразделяют соответственно на солеобразующие и несолеобразующие .
Несолеобразующих оксидов немного, все они образованы неметаллами в степени окисления +1 и +2. Список несолеобразующих оксидов следует запомнить: CO, SiO, N 2 O, NO.
Солеобразующие оксиды в свою очередь подразделяются на основные , кислотные и амфотерные .
Основными оксидами называют такие оксиды, которые при взаимодействии с кислотами (или кислотными оксидами) образуют соли. К основным оксидам относят оксиды металлов в степени окисления +1 и +2, за исключением оксидов BeO, ZnO, SnO, PbO.
Кислотными оксидами называют такие оксиды, которые при взаимодействии с основаниями (или основными оксидами) образуют соли. Кислотными оксидами являются практически все оксиды неметаллов за исключением несолеобразующих CO, NO, N 2 O, SiO, а также все оксиды металлов в высоких степенях окисления (+5, +6 и +7).
Амфотерными оксидами называют оксиды, которые могут реагировать как с кислотами, так и основаниями, и в результате этих реакций образуют соли. Такие оксиды проявляют двойственную кислотно-основную природу, то есть могут проявлять свойства как кислотных, так и основных оксидов. К амфотерным оксидам относятся оксиды металлов в степенях окисления +3, +4, а также в качестве исключений оксиды BeO, ZnO, SnO, PbO.
Некоторые металлы могут образовывать все три вида солеобразующих оксидов. Например, хром образует основный оксид CrO, амфотерный оксид Cr 2 O 3 и кислотный оксид CrO 3 .
Как можно видеть, кислотно-основные свойства оксидов металлов напрямую зависят от степени окисления металла в оксиде: чем больше степень окисления, тем сильнее выражены кислотные свойства.
Основания
Основания — соединения с формулой вида Me(OH) x , где x чаще всего равен 1 или 2.
Исключения: Be(OH) 2 , Zn(OH) 2 , Sn(OH) 2 и Pb(OH) 2 не относятся к основаниям, несмотря на степень окисления металла +2. Данные соединения являются амфотерными гидроксидами, которые еще будут рассмотрены в этой главе более подробно.
Классификация оснований
Основания классифицируют по количеству гидроксогрупп в одной структурной единице.
Основания с одной гидроксогруппой, т.е. вида MeOH, называют однокислотными основаниями, с двумя гидроксогруппами, т.е. вида Me(OH) 2 , соответственно, двухкислотными и т.д.
Также основания подразделяют на растворимые (щелочи) и нерастворимые.
К щелочам относятся исключительно гидроксиды щелочных и щелочно-земельных металлов, а также гидроксид таллия TlOH.
Номенклатура оснований
Название основания строится по нижеследующему принципу:
Например:
Fe(OH) 2 — гидроксид железа (II),
Cu(OH) 2 — гидроксид меди (II).
В тех случаях, когда металл в сложных веществах имеет постоянную степень окисления, указывать её не требуется. Например:
NaOH — гидроксид натрия,
Ca(OH) 2 — гидроксид кальция и т.д.
Кислоты
Кислоты — сложные вещества, молекулы которых содержат атомы водорода, способные замещаться на металл.
Общая формула кислот может быть записана как H x A, где H — атомы водорода, способные замещаться на металл, а A — кислотный остаток.
Например, к кислотам относятся такие соединения, как H 2 SO 4 , HCl, HNO 3 , HNO 2 и т.д.
Классификация кислот
По количеству атомов водорода, способных замещаться на металл, кислоты делятся на:
— одноосновные кислоты : HF, HCl, HBr, HI, HNO 3 ;
— двухосновные кислоты : H 2 SO 4 , H 2 SO 3 , H 2 CO 3 ;
— трехосновные кислоты : H 3 PO 4 , H 3 BO 3 .
Следует отметить, что количество атомов водорода в случае органических кислот чаще всего не отражает их основность. Например, уксусная кислота с формулой CH 3 COOH, несмотря на наличие 4-х атомов водорода в молекуле, является не четырех-, а одноосновной. Основность органических кислот определяется количеством карбоксильных групп (-COOH) в молекуле.
Также по наличию кислорода в молекулах кислоты подразделяют на бескислородные (HF, HCl, HBr и т.д.) и кислородсодержащие (H 2 SO 4 , HNO 3 , H 3 PO 4 и т.д.). Кислородсодержащие кислоты называют также оксокислотами .
Более детально про классификацию кислот можно почитать .
Номенклатура кислот и кислотных остатков
Нижеследующий список названий и формул кислот и кислотных остатков обязательно следует выучить.
В некоторых случаях облегчить запоминание может ряд следующих правил.
Как можно видеть из таблицы выше, построение систематических названий бескислородных кислот выглядит следующим образом:
Например:
HF — фтороводородная кислота;
HCl — хлороводородная кислота;
H 2 S — сероводородная кислота.
Названия кислотных остатков бескислородных кислот строятся по принципу:
Например, Cl — — хлорид, Br — — бромид.
Названия кислородсодержащих кислот получают добавлением к названию кислотообразующего элемента различных суффиксов и окончаний. Например, если кислотообразующий элемент в кислородсодержащей кислоте имеет высшую степень окисления, то название такой кислоты строится следующим образом:
Например, серная кислота H 2 S +6 O 4 , хромовая кислота H 2 Cr +6 O 4 .
Все кислородсодержащие кислоты могут быть также классифицированы как кислотные гидроксиды, поскольку в их молекулах обнаруживаются гидроксогруппы (OH). Например, это видно из нижеследующих графических формул некоторых кислородсодержащих кислот:
Таким образом, серная кислота иначе может быть названа как гидроксид серы (VI), азотная кислота — гидроксид азота (V), фосфорная кислота — гидроксид фосфора (V) и т.д. При этом число в скобках характеризует степень окисления кислотообразующего элемента. Такой вариант названий кислородсодержащих кислот многим может показаться крайне непривычным, однако же изредка такие названия можно встретить в реальных КИМах ЕГЭ по химии в заданиях на классификацию неорганических веществ.
Амфотерные гидроксиды
Амфотерные гидроксиды — гидроксиды металлов, проявляющие двойственную природу, т.е. способные проявлять как свойства кислот, так и свойства оснований.
Амфотерными являются гидроксиды металлов в степенях окисления +3 и +4 (как и оксиды).
Также в качестве исключений к амфотерным гидроксидам относят соединения Be(OH) 2 , Zn(OH) 2 , Sn(OH) 2 и Pb(OH) 2 , несмотря на степень окисления металла в них +2.
Для амфотерных гидроксидов трех- и четырехвалентных металлов возможно существование орто- и мета-форм, отличающихся друг от друга на одну молекулу воды. Например, гидроксид алюминия (III) может существовать в орто-форме Al(OH) 3 или мета-форме AlO(OH) (метагидроксид).
Поскольку, как уже было сказано, амфотерные гидроксиды проявляют как свойства кислот, так и свойства оснований, их формула и название также могут быть записаны по-разному: либо как у основания, либо как у кислоты. Например:
Соли
Соли — это сложные вещества, в состав которых входят катионы металлов и анионы кислотных остатков.
Так, например, к солям относятся такие соединения как KCl, Ca(NO 3) 2 , NaHCO 3 и т.д.
Представленное выше определение описывает состав большинства солей, однако же существуют соли, не попадающие под него. Например, вместо катионов металлов в состав соли могут входить катионы аммония или его органические производные. Т.е. к солям относятся такие соединения, как, например, (NH 4) 2 SO 4 (сульфат аммония), + Cl — (хлорид метиламмония) и т.д.
Также противоречат определению солей выше класс так называемых комплексных солей, которые будут рассмотрены в конце данной темы.
Классификация солей
С другой стороны, соли можно рассматривать как продукты замещения катионов водорода H + в кислоте на другие катионы или же как продукты замещения гидроксид-ионов в основаниях (или амфотерных гидроксидах) на другие анионы.
При полном замещении образуются так называемые средние или нормальные соли. Например, при полном замещении катионов водорода в серной кислоте на катионы натрия образуется средняя (нормальная) соль Na 2 SO 4 , а при полном замещении гидроксид-ионов в основании Ca(OH) 2 на кислотные остатки нитрат-ионы образуется средняя (нормальная) соль Ca(NO 3) 2 .
Соли, получаемые неполным замещением катионов водорода в двухосновной (или более) кислоте на катионы металла, называют кислыми. Так, при неполном замещении катионов водорода в серной кислоте на катионы натрия образуется кислая соль NaHSO 4 .
Соли, которые образуются при неполном замещении гидроксид-ионов в двухкислотных (или более) основаниях, называют осно вными солями. Например, при неполном замещении гидроксид-ионов в основании Ca(OH) 2 на нитрат-ионы образуется осно вная соль Ca(OH)NO 3 .
Соли, состоящие из катионов двух разных металлов и анионов кислотных остатков только одной кислоты, называют двойными солями . Так, например, двойными солями являются KNaCO 3 , KMgCl 3 и т.д.
Если соль образована одним типом катионов и двумя типами кислотных остатков, такие соли называют смешанными. Например, смешанными солями являются соединения Ca(OCl)Cl, CuBrCl и т.д.
Существуют соли, которые не попадают под определение солей как продуктов замещения катионов водорода в кислотах на катионы металлов или продуктов замещения гидроксид-ионов в основаниях на анионы кислотных остатков. Это — комплексные соли. Так, например, комплексными солями являются тетрагидроксоцинкат- и тетрагидроксоалюминат натрия с формулами Na 2 и Na соответственно. Распознать комплексные соли среди прочих чаще всего можно по наличию квадратных скобок в формуле. Однако нужно понимать, что, чтобы вещество можно было отнести к классу солей, в его состав должны входить какие-либо катионы, кроме (или вместо) H + , а из анионов должны быть какие-либо анионы помимо (или вместо) OH — . Так, например, соединение H 2 не относится к классу комплексных солей, поскольку при его диссоциации из катионов в растворе присутствуют только катионы водорода H + . По типу диссоциации данное вещество следует скорее классифицировать как бескислородную комплексную кислоту. Аналогично, к солям не относится соединение OH, т.к. данное соединение состоит из катионов + и гидроксид-ионов OH — , т.е. его следует считать комплексным основанием.
Номенклатура солей
Номенклатура средних и кислых солей
Название средних и кислых солей строится по принципу:
Если степень окисления металла в сложных веществах постоянная, то ее не указывают.
Названия кислотных остатков были даны выше при рассмотрении номенклатуры кислот.
Например,
Na 2 SO 4 — сульфат натрия;
NaHSO 4 — гидросульфат натрия;
CaCO 3 — карбонат кальция;
Ca(HCO 3) 2 — гидрокарбонат кальция и т.д.
Номенклатура основных солей
Названия основных солей строятся по принципу:
Например:
(CuOH) 2 CO 3 — гидроксокарбонат меди (II);
Fe(OH) 2 NO 3 — дигидроксонитрат железа (III).
Номенклатура комплексных солей
Номенклатура комплексных соединений значительно сложнее, и для сдачи ЕГЭ многого знать из номенклатуры комплексных солей не нужно.
Следует уметь называть комплексные соли, получаемые взаимодействием растворов щелочей с амфотерными гидроксидами. Например:
*Одинаковыми цветами в формуле и названии обозначены соответствующие друг другу элементы формулы и названия.
Тривиальные названия неорганических веществ
Под тривиальными названиями понимают названия веществ не связанные, либо слабо связанные с их составом и строением. Тривиальные названия обусловлены, как правило, либо историческими причинами либо физическими или химическими свойствами данных соединений.
Список тривиальных названий неорганических веществ, которые необходимо знать:
| Na 3 | криолит |
| SiO 2 | кварц, кремнезем |
| FeS 2 | пирит, железный колчедан |
| CaSO 4 ∙2H 2 O | гипс |
| CaC2 | карбид кальция |
| Al 4 C 3 | карбид алюминия |
| KOH | едкое кали |
| NaOH | едкий натр, каустическая сода |
| H 2 O 2 | перекись водорода |
| CuSO 4 ∙5H 2 O | медный купорос |
| NH 4 Cl | нашатырь |
| CaCO 3 | мел, мрамор, известняк |
| N 2 O | веселящий газ |
| NO 2 | бурый газ |
| NaHCO 3 | пищевая (питьевая) сода |
| Fe 3 O 4 | железная окалина |
| NH 3 ∙H 2 O (NH 4 OH) | нашатырный спирт |
| CO | угарный газ |
| CO 2 | углекислый газ |
| SiC | карборунд (карбид кремния) |
| PH 3 | фосфин |
| NH 3 | аммиак |
| KClO 3 | бертолетова соль (хлорат калия) |
| (CuOH) 2 CO 3 | малахит |
| CaO | негашеная известь |
| Ca(OH) 2 | гашеная известь |
| прозрачный водный раствор Ca(OH) 2 | известковая вода |
| взвесь твердого Ca(OH) 2 в его водном растворе | известковое молоко |
| K 2 CO 3 | поташ |
| Na 2 CO 3 | кальцинированная сода |
| Na 2 CO 3 ∙10H 2 O | кристаллическая сода |
| MgO | жженая магнезия |
Химические формула – это изображение с помощью символов .
Знаки химических элементов
Химический знак или химический символ элемента – это первая или две первые буквы от латинского названия этого элемента.
Например: Ferrum – Fe , Cuprum – Cu , Oxygenium – O и т.д.
Таблица 1: Информация, которую дает химический знак
| Сведения | На примере Cl |
| Название элемента | Хлор |
| Неметалл, галоген | |
| Один элемента | 1 атом хлора |
| (Ar) данного элемента | Ar (Cl) = 35,5 |
| Абсолютная атомная масса химического элемента
m = Ar · 1,66·10 -24 г = Ar · 1,66 · 10 -27 кг |
M (Cl) = 35,5 · 1,66 · 10 -24 = 58,9 · 10 -24 г |
Название химического знака в большинстве случаев читается как название химического элемента. Например, К – калий , Са – кальций , Mg – магний , Mn – марганец .
Случаи, когда название химического знака читается иначе, приведены в таблице 2:
| Название химического элемента | Химический знак | Название химического знака
(произношение) |
| Азот | N | Эн |
| Водород | H | Аш |
| Железо | Fe | Феррум |
| Золото | Au | Аурум |
| Кислород | O | О |
| Кремний | Si | Силициум |
| Медь | Cu | Купрум |
| Олово | Sn | Станум |
| Ртуть | Hg | Гидраргиум |
| Свинец | Pb | Плюмбум |
| Сера | S | Эс |
| Серебро | Ag | Аргентум |
| Углерод | C | Цэ |
| Фосфор | P | Пэ |
Химические формулы простых веществ
Химическими формулами большинства простых веществ (всех металлов и многих неметаллов) являются знаки соответствующих химических элементов.
Так вещество железо и химический элемент железо обозначаются одинаково – Fe .
Если имеет молекулярную структуру (существует в виде , то его формулой является химический знак элемента с индексом внизу справа, указывающим число атомов в молекуле: H 2 , O 2 , O 3 , N 2 , F 2 , Cl 2 , Br 2 , P 4 , S 8 .
Таблица 3: Информация, которую дает химический знак
| Сведения | На примере C |
| Название вещества | Углерод (алмаз, графит, графен, карбин) |
| Принадлежность элемента к данному классу химических элементов | Неметалл |
| Один атом элемента | 1 атом углерода |
| Относительная атомная масса (Ar) элемента, образующего вещество | Ar (C) = 12 |
| Абсолютная атомная масса | M (C) = 12 · 1,66 · 10-24 = 19,93 · 10 -24 г |
| Один вещества | 1 моль углерода, т.е. 6,02 · 10 23 атомов углерода |
| M (C) = Ar (C) = 12 г/моль |
Химические формулы сложных веществ
Формулу сложного вещества составляют путем записи знаков химических элементов, из которых это вещество состоит, с указанием числа атомов каждого элемента в молекуле. При этом, как правило, химические элементы записывают в порядке увеличения их электроотрицательности в соответствии со следующим практическим рядом:
Me , Si , B , Te , H , P , As , I , Se , C , S , Br , Cl , N , O , F
Например, H 2 O , CaSO 4 , Al 2 O 3 , CS 2 , OF 2 , NaH .
Исключение составляют:
- некоторые соединения азота с водородом (например, аммиак NH 3 , гидразин N 2 H 4 );
- соли органических кислот (например, формиат натрия HCOONa , ацетат кальция (CH 3 COO) 2 Ca) ;
- углеводороды (CH 4 , C 2 H 4 , C 2 H 2 ).
Химические формулы веществ, существующих в виде димеров (NO 2 , P 2 O 3 , P2 O5 , соли одновалентной ртути, например: HgCl , HgNO 3 и др.), записывают в виде N 2 O 4 , P 4 O 6 , P 4 O 10 , Hg 2 Cl 2 , Hg 2 ( NO 3) 2 .
Число атомов химического элемента в молекуле и сложном ионе определяется на основании понятия валентности или степени окисления и записывается индексом внизу справа от знака каждого элемента (индекс 1 опускается). При этом исходят из правила:
алгебраическая сумма степеней окисления всех атомов в молекуле должна быть равной нулю (молекулы электронейтральны), а в сложном ионе – заряду иона.
Например:
2Al 3 + +3SO 4 2- =Al 2 (SO 4) 3
Этим же правилом пользуются при определении степени окисления химического элемента по формуле вещества или сложного . Обычно это элемент, имеющий несколько степеней окисления. Степени окисления остальных элементов, образующих молекулу или ион должны быть известны.
Заряд сложного иона – это алгебраическая сумма степеней окисления всех атомов, образующих ион. Поэтому при определении степени окисления химического элемента в сложном ионе сам ион заключается в скобки, а его заряд выносится за скобки.
При составлении формул по валентности вещество представляют, как соединение, состоящее из двух частиц различного типа, валентности которых известны. Далее пользуются правилом:
в молекуле произведение валентности на число частиц одного типа должно быть равным произведению валентности на число частиц другого типа.
Например:
Цифра, стоящая перед формулой в уравнении реакции, называется коэффициентом . Она указывает либо число молекул , либо число молей вещества .
Коэффициент, стоящий перед химическим знаком , указывает число атомов данного химического элемента , а в случае, когда знак является формулой простого вещества, коэффициент указывает либо число атомов , либо число молей этого вещества.
Например:
- 3 Fe – три атома железа, 3 моль атомов железа,
- 2 H – два атома водорода, 2 моль атомов водорода,
- H 2 – одна молекула водорода, 1 моль водорода.
Химические формулы многих веществ были определены опытным путем, поэтому их называют «эмпирическими» .
Таблица 4: Информация, которую дает химическая формула сложного вещества
| Сведения | На примере C aCO3 |
| Название вещества | Карбонат кальция |
| Принадлежность элемента к определенному классу веществ | Средняя (нормальная) соль |
| Одна молекула вещества | 1 молекула карбоната кальция |
| Один моль вещества | 6,02 · 10 23 молекул CaCO 3 |
| Относительная молекулярная масса вещества (Мr) | Мr (CaCO3) = Ar (Ca) +Ar (C) +3Ar (O) =100 |
| Молярная масса вещества (M) | М (CaCO3) = 100 г/моль |
| Абсолютная молекулярная масса вещества (m) | M (CaCO3) = Mr (CaCO3) · 1,66 · 10 -24 г = 1,66 · 10 -22 г |
| Качественный состав (какие химические элементы образуют вещество) | кальций, углерод, кислород |
| Количественный состав вещества: | |
| Число атомов каждого элемента в одной молекуле вещества: | молекула карбоната кальция состоит из 1 атома кальция, 1 атома углерода и 3 атомов кислорода. |
| Число молей каждого элемента в 1 моле вещества: | В 1 моль СаСО 3 (6,02 ·10 23 молекулах) содержится 1 моль (6,02 ·10 23 атомов) кальция, 1 моль (6,02 ·10 23 атомов) углерода и 3 моль (3·6,02·10 23 атомов) химического элемента кислорода) |
| Массовый состав вещества: | |
| Масса каждого элемента в 1 моле вещества: | 1 моль карбоната кальция (100г) содержит химических элементов: 40г кальция , 12г углерода , 48г кислорода . |
| Массовые доли химических элементов в веществе (состав вещества в процентах по массе):
|
Состав карбоната кальция по массе:
W (Ca) = (n (Ca) ·Ar (Ca))/Mr (CaCO3) = (1·40)/100= 0,4 (40%) W (C) = (n (Ca) ·Ar (Ca))/Mr (CaCO3) = (1·12)/100= 0,12 (12%) W (О ) = (n (Ca) ·Ar (Ca))/Mr (CaCO3) = (3·16)/100= 0,48 (48%) |
| Для вещества с ионной структурой (соли, кислоты, основания) – формула вещества дает информацию о числе ионов каждого вида в молекуле, их количестве и массе ионов в 1 моль вещества:
|
Молекула СаСО 3
состоит из иона Са 2+
и иона СО 3 2-
1 моль (6,02·10 23 молекул) СаСО 3 содержит 1 моль ионов Са 2+ и 1 моль ионов СО 3 2- ; 1 моль (100г) карбоната кальция содержит 40г ионов Са 2+ и 60г ионов СО 3 2- |
| Молярный объем вещества при нормальных условиях (только для газов) | |
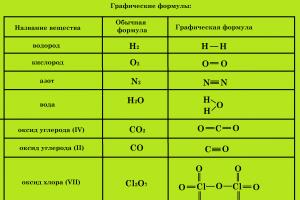
Графические формулы
Для получения более полной информации о веществе пользуются графическими формулами , которые указывают порядок соединения атомов в молекуле и валентность каждого элемента .
Графические формулы веществ, состоящих из молекул, иногда, в той или иной степени, отражают и строение (структуру) этих молекул, в этих случаях их можно назвать структурными .
Для составления графической (структурной) формулы вещества необходимо:
- Определить валентность всех химических элементов, образующих вещество.
- Записать знаки всех химических элементов, образующих вещество, каждый в количестве, равном числу атомов данного элемента в молекуле.
- Соединить знаки химических элементов черточками. Каждая черточка обозначает пару, осуществляющую связь между химическими элементами и поэтому одинаково принадлежит обоим элементам.
- Число черточек, окружающих знак химического элемента, должно соответствовать валентности этого химического элемента.
- При составлении формул кислородсодержащих кислот и их солей атомы водорода и атомы металлов связываются с кислотообразующим элементом через атом кислорода.
- Атомы кислорода соединяют друг с другом только при составлении формул пероксидов.
Примеры графических формул:

8.1. Что такое химическая номенклатура
Химическая номенклатура складывалась
постепенно, в течение нескольких столетий. По
мере накопления химических знаний она
неоднократно менялась. Уточняется и развивается
она и сейчас, что связано не только с
несовершенством некоторых номенклатурных
правил, но еще и с тем, что ученые постоянно
открывают новые и новые соединения, назвать
которые (а бывает, что даже и составить формулы),
пользуясь существующими правилами иногда
оказывается невозможно. Номенклатурные правила,
принятые в настоящее время научным сообществом
всего мира, содержатся в многотомном издании: "
Номенклатурные правила ИЮПАК по химии" , число
томов в котором непрерывно возрастает.
С типами химических формул, а также с некоторыми
правилами их составления вы уже знакомы. А какие
же бывают названия химических веществ?
Пользуясь номенклатурными правилами, можно
составить систематическое
название
вещества.
Для многих веществ кроме систематических используются и традиционные, так называемые тривиальные названия. При своем возникновении эти названия отражали определенные свойства веществ, способы получения или содержали название того, из чего данное вещество было выделено. Сравните систематические и тривиальные названия веществ, приведенных в таблице 25.
К тривиальным относятся и все названия минералов (природных веществ, составляющих горные породы), например: кварц (SiO 2); каменная соль, или галит (NaCl); цинковая обманка, или сфалерит (ZnS); магнитный железняк, или магнетит (Fe 3 O 4); пиролюзит (MnO 2); плавиковый шпат, или флюорит (CaF 2) и многие другие.
Таблица 25. Систематические и тривиальные названия некоторых веществ
Систематическое название |
Тривиальное название |
|
| NaCl | Хлорид натрия | Поваренная соль |
| Na 2 CO 3 | Карбонат натрия | Сода, кальцинированная сода |
| NaHCO 3 | Гидрокарбонат натрия | Питьевая сода |
| CaO | Оксид кальция | Негашеная известь |
| Ca(OH) 2 | Гидроксид кальция | Гашеная известь |
| NaOH | Гидроксид натрия | Едкий натр, каустическая сода, каустик |
| KOH | Гидроксид калия | Едкое кали |
| K 2 CO 3 | Карбонат калия | Поташ |
| CO 2 | Диоксид углерода | Углекислый газ, углекислота |
| CO | Монооксид углерода | Угарный газ |
| NH 4 NO 3 | Нитрат аммония | Аммиачная селитра |
| KNO 3 | Нитрат калия | Калийная селитра |
| KClO 3 | Хлорат калия | Бертолетова соль |
| MgO | Оксид магния | Жженая магнезия |
Для некоторых наиболее известных или широко
распространенных веществ употребляются только
тривиальные названия, например: вода, аммиак,
метан, алмаз, графит и другие. В этом случае такие
тривиальные названия иногда называют специальными
.
Как составляются названия веществ, относящихся к
разным классам, вы узнаете из следующих
параграфов.
| Карбонат натрия Na 2 CO 3 .
Техническое (тривиальное) название –
кальцинированная (то есть прокаленная) сода, или
просто " сода" . Белое вещество, термически
очень устойчивое (плавится без разложения),
хорошо растворяется в воде, частично с ней
реагируя, при этом в растворе создается щелочная
среда. Карбонат натрия – ионное соединение со
сложным анионом, атомы которого связаны между
собой ковалентными связями. Сода ранее широко
применялась в быту для стирки белья, но сейчас
полностью вытеснена современными стиральными
порошками. Получают карбонат натрия по довольно
сложной технологии из хлорида натрия, а
используют, в основном, в производстве стекла. Карбонат
калия К 2 СО 3 .
Техническое
(тривиальное) название – поташ. По строению,
свойствам и применению карбонат калия очень
похож на карбонат натрия. Ранее его получали из
золы растений, да и сама зола использовалась при
стирке. Сейчас большая часть карбоната калия
получается в качестве побочного продукта при
производстве глинозема (Al 2 O 3),
используемого для производства алюминия. Из-за гигроскопичности поташ применяют в качестве осушающего средства. Используют его и в производстве стекла, пигментов, жидкого мыла. Кроме этого, карбонат калия – удобный реактив для получения других соединений калия. |
ХИМИЧЕСКАЯ
НОМЕНКЛАТУРА, СИСТЕМАТИЧЕСКОЕ НАЗВАНИЕ,
ТРИВИАЛЬНОЕ НАЗВАНИЕ, СПЕЦИАЛЬНОЕ НАЗВАНИЕ.
1.Выпишите
из предыдущих глав учебника десять тривиальных
названий любых соединений (отсутствующих в
таблице), запишите формулы этих веществ и дайте
их систематические названия.
2.О чем говорят тривиальные названия "
поваренная соль" , " кальцинированная
сода" , " угарный газ" , " жженая
магнезия" ?
8.2. Названия и формулы простых веществ
Названия большинства простых веществ
совпадают с названиями соответствующих
элементов. Только все аллотропные модификации
углерода имеют свои особые названия: алмаз,
графит, карбин и другие. Кроме этого имеет свое
особое название одна из аллотропных модификаций
кислорода – озон.
Простейшая формула простого немолекулярного
вещества состоит только из символа
соответствующего элемента, например: Na –
натрий, Fe – железо, Si – кремний.
Аллотропные модификации обозначают, используя
буквенные индексы или буквы греческого алфавита:
C (а) – алмаз; -
Sn –
серое олово;
С (гр) – графит; -
Sn –
белое олово.
В молекулярных формулах молекулярных простых
веществ индекс, как вы знаете, показывает число
атомов в молекуле вещества:
H 2 – водород; O 2 – кислород; Cl 2 –
хлор; O 3 – озон.
В соответствии с номенклатурными правилами
систематическое название такого вещества должно
содержать приставку, показывающую число атомов в
молекуле:
H 2 – диводород;
O 3 – трикислород;
P 4 – тетрафосфор;
S 8 – октасера и т. д., но в настоящее время
это правило еще не стало общеупотребительным.
Таблица 26.Числовые приставки
| Множитель | Приставка | Множитель | Приставка | Множитель | Приставка |
| моно | пента | нона | |||
| ди | гекса | дека | |||
| три | гепта | ундека | |||
| тетра | окта | додека |
| Озон O 3 – светло-синий газ с характерным запахом, в жидком состоянии – темно-голубой, в твердом – темно-фиолетовый. Это вторая аллотропная модификация кислорода. Озон значительно лучше растворим в воде, чем кислород. О 3 малоустойчив и даже при комнатной температуре медленно превращается в кислород. Очень реакционноспособен, разрушает органические вещества, реагирует со многими металлами, в том числе с золотом и платиной. Почувствовать запах озона можно во время грозы, так как в природе озон образуется в результате воздействия молний и ультрафиолетового излучения на атмосферный кислород.Над Землей существует озоновый слой, расположенный на высоте около 40 км, который задерживает основную часть губительного для всего живого ультрафиолетового излучения Солнца. Озон обладает отбеливающими и дезинфицирующими свойствами. В некоторых странах он используется для дезинфекции воды. В медицинских учреждениях для дезинфекции помещений используют озон, получаемый в специальных приборах – озонаторах. |
8.3. Формулы и названия бинарных веществ
В соответствии с общим правилом в формуле
бинарного вещества на первое место ставится
символ элемента с меньшей
электроотрицательностью атомов, а на второе – с
большей, например: NaF, BaCl 2 , CO 2 , OF 2
(а не FNa, Cl 2 Ba, O 2 C или F 2 O!).
Так как значения электроотрицательности для
атомов разных элементов постоянно уточняются,
обычно пользуются двумя практическими
правилами:
1. Если бинарное соединения представляет собой
соединение элемента, образующего металл, с
элементом,
образующим неметалл, то на первое место (слева)
всегда ставится символ элемента, образующего
металл.
2. Если оба элемента, входящие в состав соединения
– элементы, образующие неметаллы, то их символы
располагают в следующей последовательности:
B, Si, C, Sb, As, P, N, H, Te, Se, S, At, I, Br, Cl, O, F.
Примечание: следует помнить, что место азота в этом практическом ряду не соответствует его электроотрицательности; в соответствии с общим правилом его следовало бы поместить между хлором и кислородом.
Примеры: Al 2 O 3 , FeO, Na 3 P, PbCl 2 , Cr 2 S 3 ,
UO 2 (по первому правилу);
BF 3 , CCl 4 , As 2 S 3 , NH 3 , SO 3 ,
I 2 O 5 , OF 2 (по второму правилу).
Систематическое название бинарного соединения
может быть дано двумя способами. Например, СО 2
можно назвать диоксидом углерода – это название
вам уже известно – и оксидом углерода(IV). Во
втором названии в скобках указывается число
Штока (степень окисления) углерода. Это делается
для того, чтобы отличить это соединение от СО –
оксида углерода(II).
Можно использовать и тот, и другой тип названия в
зависимости от того, какой в данном случае более
удобен.
Примеры (выделены более удобные названия):
| MnO | монооксид марганца | оксид марганца(II) |
| Mn 2 O 3 | триоксид димарганца | оксид марганца (III) |
| MnO 2 | диоксид марганца | оксид марганца(IV) |
| Mn 2 O 7 | гептаоксид димарганца | оксид марганца (VII) |
Другие примеры:
Если атомы элемента, стоящего в формуле
вещества на первом месте, проявляют только одну
положительную степень окисления, то ни числовые
приставки, ни обозначение этой степени окисления
в названии вещества обычно не используются,
например:
Na 2 O – оксид натрия; KCl – хлорид калия;
Cs 2 S – сульфид цезия; BaCl 2 – хлорид
бария;
BCl 3 – хлорид бора; HCl – хлорид водорода
(хлороводород);
Al 2 O 3 – оксид алюминия; H 2 S –
сульфид водорода (сероводород).
1.Составьте систематические названия веществ
(для бинарных веществ – двумя способами):
а) O 2 , FeBr 2 , BF 3 , CuO, HI;
б) N 2 , FeCl 2 , Al 2 S 3 , CuI, H 2 Te;
в) I 2 , PCl 5 , MnBr 2 , BeH 2 , Cu 2 O.
2.Назовите двумя способами каждый из оксидов
азота: N 2 O, NO, N 2 O 3 , NO 2 , N 2 O 4 ,
N 2 O 5 . Подчеркните более удобные
названия.
3.Запишите формулы следующих веществ:
а) фторид натрия, сульфид бария, гидрид стронция,
оксид лития;
б) фторид углерода(IV), сульфид меди(II), оксид
фосфора(III), оксид фосфора(V);
в) диоксид кремния, пентаоксид дийода, триоксид
дифосфора, дисульфид углерода;
г) селеноводород, бромоводород, йодоводород,
теллуроводород;
д) метан, силан, аммиак, фосфин.
4.Сформулируйте правила составления формул
бинарных веществ по положению элементов,
входящих в состав этого вещества, в системе
элементов.
8.4. Формулы и названия более сложных веществ
Как вы уже заметили, в формуле бинарного
соединения на первом месте стоит символ катиона
или атома с частичным положительным зарядом, а на
втором – аниона или атома с частичным
отрицательным зарядом. Точно также составляются
формулы и более сложных веществ, но места атомов
или простых ионов в них занимают группы атомов
или сложные ионы.
В качестве примера рассмотрим соединение (NH 4) 2 CO 3 .
В нем на первом месте стоит формула сложного
катиона (NH 4 ), а
на втором – формула сложного аниона (CO 3 2).
В формуле самого сложного иона на первое место
ставится символ центрального атома, то есть
атома, с которым связаны остальные атомы (или
группы атомов) этого иона, а в названии
указывается степень окисления центрального
атома.
Примеры систематических названий:
Na 2 SO 4 тетраоксосульфат(VI) натрия(I),
K 2 SO 3 триоксосульфат(IV) калия(II),
CaCO 3 триоксокарбонат(IV) кальция(II),
(NH 4) 3 PO 4 тетраоксофосфат(V)
аммония,
PH 4 Cl хлорид фосфония,
Mg(OH) 2 гидроксид магния(II).
Такие названия точно отражают состав
соединения, но очень громоздки. Поэтому вместо
них обычно используют сокращенные (полусистематические
)
названия этих соединений:
Na 2 SO 4 сульфат натрия,
K 2 SO 3 сульфит калия,
CaCO 3 карбонат кальция,
(NH 4) 3 PO 4 фосфат аммония,
Mg(OH) 2 гидроксид магния.
Систематические названия кислот составляется
так, как будто кислота – соль водорода:
H 2 SO 4 тетраоксосульфат(VI) водорода,
H 2 CO 3 триоксокарбонат(IV) водорода,
H 2 гексафторосиликат(IV) водорода.(О
причинах применения квадратных скобок в формуле
этого соединения вы узнаете позже)
Но для наиболее известных кислот
номенклатурные правила допускают применение их
тривиальных названий, которые вместе с
названиями соответствующих анионов приведены в
таблице 27.
Таблица 27. Названия некоторых кислот и их анионов
Название |
Формула
ПОЛУСИСТЕМАТИЧЕСКИЕ
НАЗВАНИЯ КИСЛОТ И СОЛЕЙ.
| |||
Проверить информацию. Необходимо проверить точность фактов и достоверность сведений, изложенных в этой статье. На странице обсуждения идёт дискуссия на тему: Сомнения относительно терминологии. Химическая формула … Википедия
Химическая формула отражение информации о составе и структуре веществ с помощью химических знаков, чисел и разделяющих знаков скобок. В настоящее время различают следующие виды химических формул: Простейшая формула. Может быть получена опытным… … Википедия
Химическая формула отражение информации о составе и структуре веществ с помощью химических знаков, чисел и разделяющих знаков скобок. В настоящее время различают следующие виды химических формул: Простейшая формула. Может быть получена опытным… … Википедия
Химическая формула отражение информации о составе и структуре веществ с помощью химических знаков, чисел и разделяющих знаков скобок. В настоящее время различают следующие виды химических формул: Простейшая формула. Может быть получена опытным… … Википедия
Химическая формула отражение информации о составе и структуре веществ с помощью химических знаков, чисел и разделяющих знаков скобок. В настоящее время различают следующие виды химических формул: Простейшая формула. Может быть получена опытным… … Википедия
Основная статья: Неорганические соединения Список неорганических соединений по элементам информационный список неорганических соединений, представленный в алфавитном порядке (по формуле) для каждого вещества, водородные кислоты элементов (при их… … Википедия
Эта статья или раздел нуждается в переработке. Пожалуйста, улучшите статью в соответствии с правилами написания статей … Википедия
Химическим уравнением (уравнением химической реакции) называют условную запись химической реакции с помощью химических формул, числовых коэффициентов и математических символов. Уравнение химической реакции даёт качественную и количественную… … Википедия
Химическое программное обеспечение компьютерные программы, используемые в области химии. Содержание 1 Химические редакторы 2 Платформы 3 Литература … Википедия
Книги
- Японско-англо-русский словарь по монтажу промышленного оборудования. Около 8 000 терминов , Попова И.С.. Словарь предназначен для широкого круга пользователей и прежде всего для переводчиков и технических специалистов, занимающихся поставками и внедрением промышленного оборудования из Японии или…
- Краткий словарь биохимических терминов , Кунижев С.М.. Словарь предназначен для студентов химических и биологических специальностей университетов, изучающих курс общей биохимии, экологии и основ биотехнологии, а также может быть использован в…
Общеизвестна формула основы жизни - воды. Её молекула состоит из двух атомов водорода и одного кислорода, что записывается как H2O. Если же кислорода будет в два раза больше, то получится совсем другое вещество - H2O2. Что это и чем полученное вещество будет отличаться от своей «родственницы» воды?
H2O2 - что это за вещество?
Остановимся на нем подробнее. H2O2 - формула перекиси водорода, Да, той самой, которой обрабатывают царапины, белой. Пероксид водорода H2O2 - научное.
Для дезинфекции используют трехпроцентный раствор перекиси. В чистом или концентрированном виде она вызывает химические ожоги кожи. Тридцатипроцентный раствор перекиси иначе называют пергидроль; раньше его применяли в парикмахерских для обесцвечивания волос. Обожженная им кожа также становится белой.
Химические свойства Н2О2
Перекись водорода представляет собой жидкость без цвета и с «металлическим» привкусом. Является хорошим растворителем и сама легко растворяется в воде, эфире, спиртах.
Трёх- и шестипроцентные растворы перекиси обычно готовят, разбавляя тридцатипроцентный раствор. При хранении концентрированного Н2О2 происходит разложение вещества с выделением кислорода, поэтому в плотно закупоренных емкостях его хранить не следует во избежание взрыва. С уменьшением концентрации пероксида, повышается его устойчивость. Также для замедления разложения Н2О2 можно добавлять в него различные вещества, например, фосфорную или салициловую кислоту. Для хранения растворов сильной концентрации (более 90 процентов) в перекись добавляют пирофосфат натрия, который стабилизирует состояние вещества, а также используют сосуды из алюминия.

Н2О2 в химических реакциях может быть как окислителем, так и восстановителем. Однако чаще пероксид проявляет окислительные свойства. Перекись принято считать кислотой, но очень слабой; соли перекиси водорода называют пероксидами.
как метод получения кислорода
Реакция разложения Н2О2 происходит при воздействии на вещество высокой температуры (более 150 градусов Цельсия). В результате образуются вода и кислород.
Формула реакции - 2 Н2О2 + t -> 2 Н2О + О2
Степень окисления Н в Н 2 О 2 и Н 2 О = +1.
Степень окисления О: в Н 2 О 2 = -1, в Н 2 О = -2, в О 2 = 0
2 О -1 - 2е -> О2 0
О -1 + е -> О -2
2 Н2О2 = 2 Н2О + О2
Разложение перекиси водорода может произойти и при комнатной температуре, если использовать катализатор (химическое вещество, ускоряющее реакцию).
В лабораториях одним из методов получения кислорода, наряду с разложением бертолетовой соли или марганцовки, является реакция разложения перекиси. В таком случае в качестве катализатора используют оксид марганца (IV). Другие вещества, ускоряющие разложение H2O2, - медь, платина, гидроксид натрия.
История открытия перекиси
Первые шаги к открытию перекиси были сделаны в 1790 году немцем Александром Гумбольдтом, когда он обнаружил превращения оксида бария в пероксид при нагревании. Тот процесс сопровождался поглощением кислорода из воздуха. Через двенадцать лет учеными Тенаром и Гей-Люссаком был проведен опыт по сжиганию щелочных металлов с избытком кислорода, в результате чего был получен пероксид натрия. Но пероксид водорода был получен позже, лишь в 1818 году, когда Луи Тенар изучал воздействие кислот на металлы; для их устойчивого взаимодействия было необходимо низкое количество кислорода. Проводя подтверждающий опыт с перекисью бария и серной кислотой, ученый добавил к ним воду, хлористый водород и лёд. Через непродолжительное время, Тенар обнаружил на стенках емкости с пероксидом бария небольшие застывшие капли. Стало ясно, что это H2O2. Тогда дали полученному H2O2 название «окисленная вода». Это и была перекись водорода - бесцветная, ничем не пахнущая, трудноиспаримая жидкость, хорошо растворяющая другие вещества. Результат взаимодействия H2O2 и H2O2 - реакция диссоциации, перекись растворима в воде.

Интересный факт - быстро обнаружились свойства нового вещества, позволяющие использовать его в реставрационных работах. Сам Тенар при помощи пероксида отреставрировал картину Рафаэля, потемневшую от времени.
Перекись водорода в XX веке
После тщательного изучения полученного вещества его стали производить в промышленных масштабах. В начале двадцатого века ввели электрохимическую технологию производства перекиси, основанную на процессе электролиза. Но срок годности полученного таким методом вещества был невелик, около пары недель. Чистая перекись нестабильна, и по большей части её выпускали в тридцатипроцентной концентрации для отбеливания ткани и в трёх- или шестипроцентной - для бытовых нужд.
Учёные фашистской Германии использовали пероксид для создания ракетного двигателя на жидком топливе, который использовался для оборонных нужд во Второй Мировой войне. В результате взаимодействия Н2О2 и метанола/гидразина, получалось мощное топливо, на котором самолет достигал скорости более 950 км/ч.
Где применяется Н2О2 сейчас?
- в медицине - для обработки ран;
- в целлюлозно-бумажной промышленности используются отбеливающие свойства вещества;
- в текстильной промышленности перекисью отбеливают натуральные и синтетические ткани, меха, шерсть;
- как ракетное топливо или его окислитель;
- в химии - для получения кислорода, как пенообразователь для производства пористых материалов, как катализатор или гидрирующий агент;
- для производства дезинфицирующих или чистящих средств, отбеливателей;
- для обесцвечивания волос (это устаревший метод, так как волосы сильно повреждаются пероксидом);

Перекись водорода можно успешно применять для решения разных бытовых задач. Но использовать в этих целях можно лишь трёхпроцентную перекись водорода. Вот некоторые способы:
- Для очистки поверхностей нужно залить перекись в сосуд пульверизатором и разбрызгивать на загрязненные места.
- Для дезинфекции предметов их нужно протереть неразбавленным раствором Н2О2. Это поможет очистить их от вредных микроорганизмов. Губки для мытья можно замочить в воде с перекисью (пропорция 1:1).
- Для отбеливания тканей при стирке белых вещей добавляют стакан пероксида. Можно также выполоскать белые ткани в воде, смешанной со стаканом Н2О2. Этот способ возвращает белизну, предохраняет ткани от пожелтения и помогает удалить трудновыводимые пятна.
- Для борьбы с плесенью и грибком следует смешать в емкости с пульверизатором перекись и воду в пропорции 1:2. Полученную смесь распылять на зараженные поверхности и через 10 минут очищать их при помощи щётки или губки.
- Обновить потемневшую затирку в кафельной плитке можно, распылив пероксид на нужные участки. Через 30 минут нужно тщательно потереть их жесткой щёткой.
- Для мытья посуды полстакана Н2О2 добавить в полный таз с водой (или раковину с закрытым сливом). Промытые в таком растворе чашки и тарелки будут сиять чистотой.
- Чтобы очистить зубную щётку, нужно опустить её в неразведенный трёхпроцентный раствор перекиси. Затем промыть под сильной струей воды. Этот способ хорошо дезинфицирует предмет гигиены.
- Чтобы продезинфицировать купленные овощи и фрукты, следует распылить на них раствор 1 части перекиси и 1 части воды, после чего тщательно промыть их водой (можно холодной).
- На дачном участке при помощи Н2О2 можно бороться с болезнями растений. Нужно опрыскивать их раствором перекиси или замочить семена незадолго до посадки в 4,5 литрах воды, смешанной с 30 мл сорокапроцентной перекиси водорода.
- Для оживления аквариумных рыбок, если они отравились аммиаком, задохнулись при отключении аэрации или по другой причине, можно попробовать поместить их в воду с перекисью водорода. Нужно смешать трёхпроцентную перекись с водой из расчёта 30 мл на 100 литров и поместить в полученную смесь бездыханных рыб на 15-20 минут. Если они не оживут за это время, значит, средство не помогло.

Даже в результате активного встряхивания бутылки с водой в ней образуется некоторое количество пероксида, так как вода при этом действии насыщается кислородом.
В свежих фруктах и овощах Н2О2 также содержится, пока они не подвергнутся термической обработке. При нагреве, варке, обжарке и других процессах с сопутствующей высокой температурой уничтожается большое количество кислорода. Именно поэтому прошедшие кулинарную обработку продукты считаются не такими полезными, хотя какое-то количество витаминов в них остается. Свежевыжатые соки или кислородные коктейли, подаваемые в санаториях, полезны по той же причине - из-за насыщения кислородом, который дает организму новые силы и очищает его.
Опасность перекиси при употреблении внутрь
После вышесказанного может показаться, что перекись можно специально принимать внутрь, и от этого будет польза организму. Но это совсем не так. В воде или соках соединение содержится в минимальных количествах и тесно связано с другими веществами. Прием же «ненатуральной» перекиси водорода внутрь (а вся перекись, купленная в магазине или произведенная в результате химических опытов самостоятельно, никак не может считаться натуральной, к тому же обладает слишком высокой концентрацией по сравнению с природной) может привести к опасным для жизни и здоровья последствиям. Чтобы понять - почему, нужно вновь обратиться к химии.
Как уже упомянуто, при некоторых условиях пероксид водорода разрушается и выделяет кислород, являющийся активным окислителем. может произойти при столкновении Н2О2 с пероксидазой - внутриклеточным ферментом. В основе использования перекиси для дезинфекции положены именно её окислительные свойства. Так, когда рану обрабатывают Н2О2 - выделяющийся кислород уничтожает живые патогенные микроорганизмы, попавшие в нее. Такое же действие она оказывает и на другие живые клетки. Если обработать неповрежденную кожу пероксидом, а потом протереть место обработки спиртом, почувствуется жжение, что подтверждает наличие микроскопических повреждений после перекиси. Но при внешнем применении перекиси низкой концентрации какого-то заметного вреда организму не будет.

Другое дело, если её пытаться принимать внутрь. То вещество, которое способно повреждать даже сравнительно толстую кожу снаружи, попадает на слизистые оболочки пищеварительного тракта. То есть происходят химические мини-ожоги. Разумеется, выделяющийся окислитель - кислород - может заодно убить и вредные микробы. Но этот же процесс произойдет и с клетками пищевого тракта. Если ожоги в результате действия окислителя будут повторяться, то возможна атрофия слизистых оболочек, а это - первый шаг на пути к раку. Гибель клеток кишечника приводит к невозможности организма усваивать питательные вещества, этим объясняется, например, снижение веса и исчезновение запоров у некоторых людей, практикующих «лечение» перекисью.
Отдельно нужно сказать о таком методе употребления перекиси, как внутривенные инъекции. Даже если по какой-то причине их назначил врач (оправдано это может быть лишь при заражении крови, когда других подходящих лекарств в наличии нет), то под медицинским наблюдением и со строгим расчетом дозировок риски все-таки есть. Но в такой экстремальной ситуации это будет шансом на выздоровление. Самому же назначать себе уколы перекиси водорода ни в коем случае нельзя. Н2О2 представляет большую опасность для клеток крови - эритроцитов и тромбоцитов, так как при попадании в кровеносное русло разрушает их. К тому же, может произойти смертельно опасная закупорка сосудов высвободившимся кислородом - газовая эмболия.
Меры безопасности в обращении с Н2О2
- Хранить в недоступном для детей и недееспособных лиц месте. Отсутствие запаха и выраженного вкуса делает перекись особенно опасной для них, так как могут быть приняты большие дозы. При попадании внутрь раствора, последствия употребления могут быть непредсказуемыми. Необходимо незамедлительно обратиться к врачу.
- Растворы перекиси концентрацией более трёх процентов вызывают ожоги при попадании на кожу. Место ожога нужно промыть большим количеством воды.

- Не допускать попадания раствора пероксида в глаза, так как образуется их отек, покраснение, раздражение, иногда болевые ощущения. Первая помощь до обращения к врачу - обильное промывание глаз водой.
- Хранить вещество так, чтобы было понятно, что это - H2O2, то есть в емкости с наклейкой во избежание случайного применения не по назначению.
- Условия хранения, продлевающие его срок, - темное, сухое, прохладное место.
- Нельзя смешивать пероксид водорода с любыми жидкостями, кроме чистой воды, в том числе и с хлорированной водой из-под крана.
- Все вышесказанное применимо не только к Н2О2, но и ко всем содержащим его препаратам.