Fab fc фрагменты. Основные функции Fab и Fc-фрагментов. Смотреть что такое "Fab-фрагмент" в других словарях
Fab-фрагмент
(лат. fragmentum обломок, кусок)
часть молекулы иммуноглобулина, отщепляемая папаином и состоящая из легкой цепи и аминоконцевой половины тяжелой цепи; несет антидетерминанту .
1. Малая медицинская энциклопедия. - М.: Медицинская энциклопедия. 1991-96 гг. 2. Первая медицинская помощь. - М.: Большая Российская Энциклопедия. 1994 г. 3. Энциклопедический словарь медицинских терминов. - М.: Советская энциклопедия. - 1982-1984 гг .
Смотреть что такое "Fab-фрагмент" в других словарях:
- … Википедия
Эта статья об иммунологии. Об украинской поп рок группе см. Антитела (группа); о фильме см. Антитела (фильм, 2005). Антитела (иммуноглобулины, ИГ, Ig) это особый класс гликопротеинов, присутствующих на… … Википедия
- (Ig), группа близких по хим. природе и св вам глобулярных белков позвоночных животных и человека, к рые обычно обладают св вами антител, т. е. специфич. способностью соединяться с антигеном, к рый стимулирует их образование. И. продуцируются В… … Химическая энциклопедия
I Антитела белки сыворотки крови и других биологических жидкостей, которые синтезируются в ответ на введение антигена и обладают способностью специфически взаимодействовать с антигеном, вызвавшим их образование, или с изолированной детерминантной … Медицинская энциклопедия
Белки группы иммуноглобулинов, образующиеся в организме человека и теплокровных животных в ответ на попадание в него веществ (антигенов) и нейтрализующие их вредное действие. Основные формы проявления активности А. – агглютинация, преципитация,… … Словарь микробиологии
Действующее вещество ›› Абциксимаб* (Abciximab*) Латинское название ReoPro АТХ: ›› B01AC13 Абциксимаб Фармакологическая группа: Антиагреганты Нозологическая классификация (МКБ 10) ›› I20 Стенокардия [грудная жаба] ›› I20.0 Нестабильная… … Словарь медицинских препаратов
ДУША - [греч. ψυχή], вместе с телом образует состав человека (см. статьи Дихотомизм, Антропология), будучи при этом самостоятельным началом; Д. человека заключает образ Божий (по мнению одних отцов Церкви; по мнению других образ Божий заключен во всем… … Православная энциклопедия
- (Apollo, Απόλλων). Божество солнца, сын Зевса и Лето (Латоны), брат близнец богини Артемиды. Аполлон считался также богом музыки и искусств, богом прорицания и покровителем стад и скота. Он принимает живое участие в основании городов и управлении … Энциклопедия мифологии
ДИОНИСИЙ ВЕЛИКИЙ - [греч. Διονύσιος ὁ Μέγας] (кон. II в. 264/5), свт.,исп. (пам. 5 окт., пам. греч. 3 окт.), еп. Александрийский, богослов, церковно общественный деятель. Жизнь Основным источником жизнеописания Д. В. являются сочинения Евсевия Кесарийского… … Православная энциклопедия
- (Actaeon, Άχταίων). Знаменитый охотник, сын Аристея и Автонии. Однажды на охоте он увидел купающуюся Артемиду и ее нимф, за что был превращен богиней в оленя и был растерзан своими 50 псами. По другой легенде, Артемида превратила его в оленя за… … Энциклопедия мифологии
- (Άθηνά), в греческой мифологии богиня мудрости и справедливой войны. Догреческое происхождение образа А. не позволяет раскрыть этимологию имени богини, исходя из данных только греческого языка. Миф о рождении А. от Зевса и Метиды («мудрости»,… … Энциклопедия мифологии
Изобретение относится к области медицины, в частности к иммунологии, и может применяться для нейтрализации TNF y пациента, нуждающегося в такой нейтрализации. Пациенту вводят IgG - Fab-фрагмент, обладающий реактивностью по отношению к TNF.Указанный Fab-фрагмент происходит от поликлонального IgG. Причем пациент страдает септическим шоком или симптомами септического шока. Для нейтрализации TNF также используют фармацевтическую композицию, которая содержит IgG - Fab-фрагмент, обладающий реактивностью по отношению к TNF и физиологически приемлемый носитель, а Fab-фрагмент происходит от поликлонального IgG. Способ и композиция обеспечивают повышение эффективности лечения симптомов септического шока. 4 с. и 5 з.п. ф-лы, 3 табл., 9 ил.
Настоящее изобретение относится к использованию Fab-фрагментов иммуноглобулина в терапии. Антитела образуются как часть иммунного ответа организма на попадание в него микроорганизмов или чужеродных молекул. Эти антитела представляют собой иммуноглобулин (Ig) и широко используются в клинической практике для диагностики, наблюдения, и лечения все возрастающего числа заболеваний. Основная единица, из которой образуются все молекулы антител, была обнаружена Портером (1959) Biochem J. 73, 119-126, с использованием протеолитических ферментов. Одним из наиболее важных классов иммуноглобулинов, а именно IgG, состоит из двух тяжелых и двух легких цепей, причем тяжелые цепи связаны в своей шарнирной области дисульфидными связями. Расщепление этих связей папаином приводит к образованию двух антиген-связывающих фрагментов (Fab), и и одного кристаллизующегося фрагмента (Fc), как показано на фиг. 1. Расщепление пепсином ниже шарнирной области приводит к образованию немного более мелкого Fc-фрагмента, и одного F(ab") 2 -фрагмента с двумя сайтами связывания, как показано на фиг. 1. Каждый Fab-фрагмент содержит легкую цепь и часть тяжелой цепи, и включает в себя последовательности, ответственные за специфическое связывание с микроорганизмом и чужеродной макромолекулой. Fc состоит из оставшихся частей двух тяжелых цепей, и представляет собой участок, с которым могут связываться комплемент, макрофаги, и полиморфно-ядерные лейкоциты. Две тяжелые цепи (но не легкие цепи) для каждого класса антител, т. е. IgG, IgM, IgA и IgE, являются различными. Из общего количества всех иммуноглобулинов, присутствующих в кровотоке, наибольшая доля приходится на IgG. Он состоит из одной основной иммуноглобулиновой единицы, и обладает характерной для него высокой степенью сродства к своему специфическому антигену. Структура антител и их функции более подробно раскрыты Roitt (1991) Essential Immunology,. 7th Edition, Blackwell Scientific Publications, Oxford. Вредное действие микробных патогенов может быть обусловлено высвобождением растворимых токсинов. Такими токсинами являются нейрогенные экзотоксины, высвобождаемые дифтерийной и столбнячной палочками, и различные эндотоксины, такие как липополисахариды (LPS), выделяемые клеточными стенками грам-отрицательных бактерий, и пептидоглиганы, выделяемые грам-положительными микроорганизмами. В 1890 году, фон Беринг показал, что экзогенные антитела к растворимым антигенам обладают терапевтическим действием, так, например, смертность детей от дифтерии снижалась благодаря системному введению сыворотки, полученной от лошади, гипериммунизированной дифтерийным токсоидом. Аналогичный эффект был получен и для пациентов, страдающих столбняком. В 1894 году, Кальметт (Calmette) и др. применили пассивную иммунизацию к пациентам с интоксикацией, вызванной укусом змей. В развитии синдрома септического шока принимают участие инициаторы (такие, как липополисахариды, LPS), медиаторы (включая, TNF, 1L-1 и 1L-6), и эффекторы на клеточном уровне (например, (окись азота)-синтаза в эндотелиальных клетках). Все инициаторы и медиаторы являются потенциальными антигенами, и антитела против этих макромолекул могут быть использованы для предупреждения и лечения септического шока. Некоторыми исследователями, с различной степенью успеха, были использованы поликлональные (PcAb) или моноклонельные (McAb) антитела, направленные против TNF. В то же самое время было показано, что PcAb против TNF могут предупреждать летальное действие этого цитокина (Beutler et al., (1985) Science 229, 869-871) у BALB/C-мышей. Tracey и его коллеги ((1987) Nature 330, 662-664) показали, что McAb против TNF, введенные за 1 час до контрольного заражения повианов, обеспечивают частичную защиту от поражения органов, а введение этих антител за два часа до контрольного заражения обеспечивает более полную защиту. Другими словами, моноклональные антитела (McAb) против TNF были использованы профилактически. Несколько групп исследователей продуцировали, в основном, у кроликов поликлональные антитела (PcAb) к LPS и к TNF, и продемонстрировали их эффективность против септического шока на моделях животных. Кроме того, PcAb к LPS также индуцировались у добровольцев, а затем успешно использовались (Ziegler et al., 1982) New Engl. J. Med. 307, 1225-1230). Хотя использование человеческих антител позволяет избежать риска возникновения аллергических реакций, однако такое использование не получило широкого распространения из-за этических, материально-технических, и других соображений, включая риск возможного заражения вирусной инфекцией (ВИЧ и гепатит). Поэтому большинство исследователей сконцентрировало свои усилия на продуцирование McAb. McAb имеют много преимуществ, в числе которых являются, например, их гомогенность и относительная простота их окончательной обработки, в основном, с помощью аффинной хроматографии с использованием белка A или белка G для отделения антител от других белков. Однако никто из исследователей, участвующих в разработке способов лечения септического шока, не получил и не использовал специфические Fab-фрагменты. Кроме того, никто из исследователей не продемонстрировал использование Fab-фрагментов против TNF для лечения людей, страдающих септическим шоком с явно выраженными клиническими симптомами, характерными для этого заболевания. Краткое описание изобретения
Авторами настоящей заявки было продемонстрировано, что введение Fab-фрагмента, обладающего реактивностью против TNF, оказывает положительное воздействие на пациентов, страдающих симптомами "септический шок". Кроме того, авторами настоящей заявки было неожиданно обнаружено, что Fab-фрагменты, происходящие от поликлональных антител, направленных против TNF, являются более эффективными для снижения действия TNF, чем интактный иммуноглобулин IgG против TNF, как подробно описано в примерах. Таким образом, в одном из своих аспектов, настоящее изобретение относится к способу нейтрализации действия TNF у пациентов, нуждающихся в такой нейтрализации, который предусматривает введение этому пациенту Fab-фрагмента, являющегося реакционноспособным по отношению к TNF.
Указанные пациенты обычно страдают от септического шока или от симптомов септического шока. Таким образом, в другом своем аспекте, настоящее изобретение относится к способу предупреждения или ослабления септического шока или его симптомов у пациента, предусматривающему введение пациенту IgG-Fab-фрагментов, являющихся реакционноспособными по отношению к TNF.
В другом аспекте, настоящее изобретение относится к фармацевтической композиции, содержащей IgG-Fab-фрагменты, являющиеся реактивными по отношению к TNF, и физиологически приемлемый носитель. В общих чертах, IgG-Fab-фрагменты могут быть использованы всякий раз, когда возникает необходимость в нейтрализации TNF у пациентов. Водимую дозу определяют в зависимости от веса пациента и тяжести состояния, но, в основном, специфический Fab-фрагмент против TNF может быть введен взрослым пациентам в количестве 200-2000 мг в течение 2-3 дней. В основном, если Fab-фрагмент производит от поликлональной антисыворотки и не является аффинно-очищенным, то может быть введено 120 мг/кг суммарного Fab, который содержит 20 мг/кг специфического Fab против TNF.
Предпочтительно, чтобы Fab-фрагмент был, в основном, чистым и апирогенным. Fab-фрагмент может быть, в основном, очищен с использованием хроматографической техники, такой как катионообменная хроматография, или аффинная хроматография. Предпочтительно, если Fab-фрагмент является аффинно очищенным. IgG-Fab-фрагменты настоящего изобретения или их композиции могут быть введены любым стандартным системным методом, включая парентеральную (например, внутривенную, подкожную, или внутримышечную) инъекцию. Лечение может предусматривать введение разовой дозы или нескольких разделенных доз в течение определенного периода времени. Хотя IgG-Fab-фрагмент настоящего изобретения может быть введен отдельно, однако, предпочтительно, чтобы этот фрагмент присутствовал в фармацевтической композиции в сочетании с одним или несколькими приемлемыми носителями. Носитель должен быть "приемлемым" в том смысле, что он должен быть совместимым с Fab-фрагментом, и не оказывать неблагоприятного воздействия на реципиента. Композиции, содержащие IgG-Fab-фрагменты, могут быть изготовлены в виде унифицированной лекарственной формы с использованием любых методов, которые обычно используются в фармацевтической практике. Такие методы включают в себя стадия смешивания IgG-Fab-фрагмента с носителем, состоящим из одного или нескольких вспомогательных ингредиентов. В основном, указанные композиции получают путем равномерного и тщательного размешивания активного ингредиента с жидкими носителями. Композиции, предназначенные для патентерального введения, изготавливают в виде водных или безводных стерильных растворов для инъекций, которые могут содержать антиоксиданты, буферы, бактериостаты, и растворенные вещества для придания композиции изотоничности с кровью реципиента, и в виде водных и безводных стерильных суспензий, которые могут содержать суспендирующие агенты и загустители. Эти композиции могут быть изготовлены в упаковках, рассчитанных на один прием, или в упаковках для многократного приема, например, в виде герметичных ампул и флаконов, и кроме того, они могут храниться в лиофилизированном состоянии, которое требует лишь добавления стерильного жидкого носителя, например, воды для инъекций, перед их непосредственным использованием. Таким образом могут быть приготовлены инъецируемые растворы для немедленного приема. Предпочтительными унифицированными лекарственными композициями являются композиции, содержащие суточную дозу или единицу, дневную субдозу или ее соответствующую фракцию, активного ингредиента. Ниже приводится описание настоящего изобретения, проиллюстрированное соответствующими примерами и чертежами, где:
На фиг. 1 схематически представлена структура молекулы антитела. На фиг. 2 показано воздействие антитела против TNF на давление в легочной артерии и лимфоток у овцы. На фиг. 3 показано воздействие Fab-фрагментов против TNF на липополисахарид-индуцированную смертность у мышей. На фиг. 4 показано влияние конкурентного введения IgG или Fab-фрагментов против TNF и TNF на клетки L929. На фиг. 5 показан эффект введения IgG или Fab-фрагментов против TNF через два часа после TNF-обработки. На фиг. 6. показан эффект введения IgG или Fab-фрагментов против TNF через 4 часа после TNF-обработки. На фиг. 7 показано влияние Fab-фрагмента против TNF, или физиологического раствора на температуру пациентов, которые имели до начала эксперимента нормальную температуру. На фиг. 8 показано влияние Fab-фрагмента против TNF, или физиологического раствора на температуру пациентов, которые имели до начала эксперимента повышенную температуру. На фиг. 9 показаны максимальные уровни TNF у пациентов, которым были введены физиологический раствор, контрольный Fab-фрагмент, или Fab-фрагмент против TNF.
Пример 1. Получение TNF-иммуногена для иммунизации овец
Процедура
Получение сосудов, содержащих активный TNF-иммуноген
Сосуды должны быть новыми, не должны содержать пыли, и должны быть обработаны сиалинирующей жидкостью за 48 часов до эксперимента в целях предупреждения адгезии иммуногена к стенкам сосудов. Сиалинирующий раствор необходимо заменять свежим раствором каждые 24 часа. Сиалинирование осуществляют следующим образом:
A) Сосуды ставят на металлический поднос в вытяжной шкаф
B) Сиалинизирующий раствор приготавливают в соответствии с инструкциями производителей. Затем раствор разводят до получения 0,1%-ного раствора. При этом 0,2%-ный раствор получают при использовании 99 частей воды на 1 часть AQUASIL (Торговая марка). Раствор постоянно размешивают. Сосуды должны быть наполнены раствором до краев. После этого проводят осушку воздухом по крайней мере в течение 24 часов. После хранения при 4 o C, TNF удаляют, а раствор оставляют для уравновешивания при комнатной температуре в течение по крайней мере 30 минут. Полное количество TNF для разовой ежемесячной иммунизации все группы овец отвешивают в стерильной 150-миллиметровой колбе Sterilin (торговая марка) с использованием весов. Необходимые расчеты проводят как описано ниже в главе "Вычисления, необходимые для получения иммуногена". В этих расчетах, количество иммуногена обозначается E. Любой избыток полученного иммуногена может быть сохранен, а затем использован в последующих экспериментах. Затем иммуноген растворяют в 0,9%-ном физиологическом растворе. После этого раствор размешивают при непрерывном вращении в течение по крайней мере 30 минут. Количество используемого физиологического раствора обозначали F (см. ниже). Аликвоты полученного раствора иммуногена распределяли по сосудам с использованием стерильных пипеток и устройства Pipetteman (торговая марка). Вычисления, проводимые при получении иммуногена
Каждый сосуд должен содержать количество иммуногена, достаточное для иммунизации 3 овец. Затем это полное количество иммуногена (A) делят на три и округляют до следующего значения целого числа. A/3 = B, например, 49/3 = 16,33, а после округления 17
Следовательно, количество отвешиваемого TNF составляет 3B, умноженное на количество иммуногена, требуемое для одной овцы (C). (3B)C = D, например, если иммунизирующая доза для одной овцы составляет 80 мкг, то (317)80 = 4080 мкг = 4,08 мг
Причем при взвешивании иммуногена необходимо учитывать содержание соли, которое может варьироваться от партии к партии. (D/3 TNF в используемом материале)100 = E
Например, если используемый материал содержит 95% соли и соответственно 5% TNF, то (4,08/5)100 = 81,6 мг
Затем отвешенный иммуноген растворяют в соответствующем количестве 0,9%-ного физиологического раствора, которое вычисляют путем умножения количества используемых сосудов на 4. Каждый сосуд должен содержать 4 мл физиологического раствора. B4 = F, например, 174 = 68 мл
Пример 2. Схема иммунизации, взятия образцов и крови для получения овец, иммунизированных против TNF
В нижеприведенной Таблице I дана схема введения (в течение года, каждые две недели) иммунизирующей дозы, взятия крови, и обработки отдельных образцов или всех образцов для получения овец, иммунизированных против TNF.
Образцы брали от каждого животного до первичной иммунизации. Этот уровень определял фоновый уровень для каждой овцы. При этом были использованы следующие обозначения:
1: первичная иммунизация
R#: номер повторной иммунизации, проводимой после первичной иммунизации
Образец: 5-10 мл пробы крови, взятой от каждого животного для определения титра
Кровь: 10 мл взятой крови на 1 кг веса тела
IS: Отдельный образец для оценки продуктивности отдельного животного
P: Сбор крови от всех животных
Пример 3. Получение Fab-фрагментов против TNF из частично очищенных IgG
Овец иммунизировали в соответствии с вышеприведенной схемой иммунизации определенными количествами TNF, выбранными исходя из проведенных исследований реакции "доза-ответ", как описано в примерах 1 и 2. После получения адекватных уровней специфических антител в крови (по крайней мере 3 г/л), у овец, в условиях стерильности, брали кровь, которую собирали в стерильные и апирогенные стеклянные флаконы, свертывание крови ускоряли путем использования роллер-флаконов; эти флаконы центрифугировали, после чего путем аспирации в ламинарном боксе собирали сыворотку, эту сыворотку подвергали 0,2 мкм-фильтрации и оставляли на хранение при -20 o C. Для предупреждения бактериального и пирогенного загрязнения, продукт был подвергнут тщательному анализу. От различных животных собирали антисыворотки, и их иммуноглобулины осаждали при 25 o C сульфатом натрия в целях их отделения от многих других сывороточных белков, включая альбумин. Иммуноглобулины, которые представляют, в основном, антитела класса IgG, промывали стерильным сульфатом натрия, и ресуспендировали в физиологическом растворе. Гидролиз папаином: Следующая стадия представляет собой расщепление антител на Fab и Fc-фрагменты с использованием папаина, активированного цистеином и EDTA. Эту стадию осуществляют в условиях, обеспечивающих полную деградацию интактного IgG. Кристаллизующийся фрагмент Fc удаляли путем центрифугирования. Супернатант после гидролиза папаином и центрифугирования содержит: (1) специфический Fab-фрагмент, направленный против нужного растворимого антигена, (2) неспецифический Fab-фрагмент, направленный против различных других эпитопов, и не представляющий интереса для рассматриваемой терапии, (3) небольшие количества белка (включая альбумин) и другие примеси, и (4) неактивированный папаин. Аффинная хроматография
Аффинная очистка. Аффинную очистку Fab-фрагмента, направленного против фактора некроза опухоли человека (TNF), осуществляли с использованием среды, содержащей сшитую агарозу (Sepharose), с которой был связан rTNF (рекомбинантный человеческий TNF). Для связывания rTNF со средой использовали изомочевинную связь. Изготовление матриц для аффинной хроматографии на колонке с агарозой rTNF
Материалы
Сефароза 4B, активированная бромцианом (Pharmacia, Uppsala Швеция)
RTNF (R/D Systems Minneapoplis, USA)
Корпус для афинных колонок BPG (Pharmacia)
Большая воронка из спеченного стекла
Колба Бюхнера
Вакуумный насос
Стеклянный стержень
Колба Налгена (Nalgen)
Буферы и растворы:
Все буферы должны быть стерильными и апирогенными (см. SOP 0,2, получение стерильных апирогенных буферов для терапевтического применения). Соляная кислота (1 мМ, 200 мг/г, охлажденная льдом)
Бикарбонат натрия (0,1 М, pH 8,3), содержащий хлорид натрия (0,5 М)
Этаноламин (1,0 М, pH 8,0)
Ацетат натрия (0,1 М, pH 4,0), содержащий хлорид натрия (0,5 М)
Процедура: При подготовке колонок, предназначеных для терапевтических целей, все процедуры должны проводиться в ламинарном потоке в условиях класса 100, а все оборудование должно быть стерильным и апирогенным. Набухание и промывка геля: необходимое количесвто лиофилизированного порошка Сефарозы отвешивали в пластиковый флакон Налгена, и суспендировали в HCl (охлажденном льдом). Затем набухший сразу после этого гель промывали в течение 15 минут на фильтре из спеченного стекла тем же самым раствором (200 мл/г геля). Раствор добавляли в нескольких аликвотах, и после добавления последней аликвоты, гель осушали до тех пор, пока на его поверхности не появлялись трещины. Связывание лиганда: TNF лиганд (5 мг/г используемого геля) растворяли в натрийбикарбонатном буфере (0,1 М, pH 8,3, 7 мг/г используемого геля) в пластиковых флаконах Налгена. После растворения брали аликвоты (0,25% от полного количества), и добавляли осушенный воздухом гель, при этом необходимо следить за тем, чтобы лигандный раствор не выплескивался из флакона. Затем полученную смесь подвергали непрерывному вращению в течение ночи при 4 o C. Блокирование активных групп на геле: после процедуры связывания, проводимой в течение ночи, гель переносили обратно на воронку из спеченного стекла, лигандный раствор отсасывали и собирали. Затем гель промывали 200 миллилитрами этаноламина. Все промывки собирали. После этого гель переносили во флаконы Налгена, содержащего этаноламин (1,0 М, pH 8,0), и смесь вращали в течение ночи, как описано выше. Промывка геля: блокированный гель переносили на воронку из спеченного стекла, после чего этаноломиновый раствор отсасывали и собирали. Затем гель промывали буфером для связывания (бикарбонатом), после этого ацетатным буфером, а затем снова буфером для связывания. Все промывки собирали. Затем гель может быть перенесен и упакован внутри колонки, после чего он моет быть тщательно промыт физиологическим раствором (0,9%). Эффективность связывания определяли путем измерения количества белка в промывках с последующим сравнением этого количества с аликвотой исходного лигандного раствора. После получения каждой партии материала и до первого добавления раствора полного Fab-гидролизата, колонки подвергали санитарной обработке. Fab-раствор вращали со скоростью потока 1 мл/мин в течение по крайней мере двух часов при 18 o C. Затем проводили десорбцию Fab против rTNF-токсина от носителя. Fab-фрагмент против овечьего rTNF, связанный с носителем, удаляли путем промывания колонки глицином (10 мМ, pH 2,5). Элюент собирали в цитратный буфер (0,6 М, pH 8,0: 2,5%-ная конечная концентрация), и оставляли на хранение в 2-литровых сборниках Налгена для одноразового использования. Затем брали образцы для QC-испытаний (GF-FPLC, pH, концентрация белка, стерильность, и LAL-тест) (QC - тест на качество, GF-гель-фильтрация, LAL-тест = лимулюс-тест: проба с лизатом амебоцитов -Прим. пер.)
Аффинные колонки уравновешивали с использованием фосфатного буфера (10 мМ, pH 7,3) до тех пор, пока pH элюента не становился равным приблизительно pH 5,5. Затем колонку уравновешивали физиологическим раствором (0,9%) для подготовки следующего цикла. Дополнительно или альтернативно может быть также использована катионообменная хроматография. Катионообменная хроматография
Полный Fab-раствор (в аммонийацетатном буфере) наносили на катионообменную колонку (BioRad MacroPrepS, в настоящий момент, хотя, в будущем, она может быть заменена на колонку с более слабым связыванием), где связывается большая часть (> 80%) Fab. Затем эту колонку, а следовательно, и связанные Fab промывали буфером (аммонийацетатным, pH 4,0) в объеме, составляющим три объема колонки, в целях санации продукта и удаления возможного загрязнения прионом или вирусами. После этой промывки, связанные полные Fab, элюировали путем промывания колонки буфером, содержащим хлорид натрия (0,5 М). Затем элюированные Fab подвергали ультрафильтрации, и промывали физиологическим раствором для удаления аммонийацетатного буфера, после чего, если это требовалось, концентрировали, и подавали насосом в стерильный полиэтиленовый мешок для переноса образцов. Этот мешок был непосредственно прикреплен к разливочной машине. Затем продукт окончательно фильтровали, разливали, окончательно расфасовывали, и лиофилизовали. Ионообменную колонку подвергали санитарной обработке между циклами с использованием гидроксида натрия (1,0 М), а затем снова уравновешивали аммонийацетатным буфером, после чего колонка была готова для проведения следующего цикла. Пример 4. Биологическое действие IgG против овечьих TNF
Результаты исследований, проведенных с использованием интактных и очищенных не аффинным способом антител, а также овечьей модели септического шока, показаны на фиг. 2. Эти антитела частично предупреждают повышение давления в легочной артерии и повышение лимфотока в легких, которое наблюдается в контрольной группе, не обработанной иммуноглобулинами IgG против TNF
Пример 5. Биологическое действие Fab-фрагментов против овечьих TNF у мышей
Результаты исследований, проведенных с использованием специфических Fab-фрагментов против овечьих TNF инъецированных мышам с летальной дозой эндотоксина, показаны на фиг. 3. 90% мышей, которым вводили эндотоксин, погибали на 4-й день. При введении мышам специфических Fab-фрагментов в концентрации 2 мг/кг и 20 мг/кг, этот процент снижался до 80% и 30%, соответственно. Пример 6. Сравнение защитного действия анти TNF-IgG и анти TNF-Fab-фрагментов, направленного против цитотоксичного действия TNF
Авторами настоящей заявки было проведено исследование защитного действия анти- TNF-IgG и анти-TNF Fab-фрагментов, направленного против цитотоксичности TNF , на клетках L929. При культивировании указанных выделенных клеток in vitro, добавление 10 нг/мл TNF к культуральной среде приводило к лизису клеток (о чем свидетельствовало снижение оптической плотности, как показано на фиг. 4). Одновременное добавление 100 мкг/мл IgG или Fab оказывало значительное защитное действие на клетки путем связывания антител с TNF и его нейтрализации, при этом защитное действие IgG лишь незначительно превышало защитное действие Fab. На фиг. 5, а особенно на фиг. 6 показаны совершенно неожиданные результаты. При добавлении антител через 2 или 4 часа после добавления TNF, защитное действие Fab-фрагментов значительно превышало защитное действие интактного IgG. Таким образом, совершенно очевидно, что усиление защитного действия обусловлено задержкой в добавлении специфических Fab-фрагментов. На основании этих данных можно сделать вывод, что Fab-фрагменты могут быть также использованы in vivo (т.е., введены пациенту) через 2 или 4 часа после увеличения уровней TNF во время септического шока. Пример 7. Клинические испытания использования анти TNF-Fab-фрагментов для предупреждения или ослабления реакции Джарича-Херксхеймера (JHP) после противомикробного лечения эпидемического возвратного тифа
После пандемии, охватившей страны Африки, Среднего востока и Европы в начале века, Эфиопия остается единственным регионом, где до сих пор имеют место вспышки эпидемий эпидемического возвратного тифа (LBRF). При некоторых эпидемиях, смертность людей, не получавших лечения, превышала 50%, однако, хотя противомикробное лечение является эффективным против спирохетоза, вызываемого Borrelia recurrentis и способствует предупреждению рецидивов заболевания, оно, тем не менее, ассоциируется с опасной для жизни реакцией Джарича-Херксхеймера (JHP), которая по своему проявлению напоминает классическую эндотоксиновую лихорадку. JHP связана с эксплозивным выбросом фактора некроза опухоли (TNF), 1L-6 и 1L-8. Было проведено испытание рандомизированным двойным слепым методом нового овечьего поликлонального Fab-антитела против TNF, которое было осуществлено в Аддис-Абебе с участием 49 пациентов, страдающих LBRF. За 30 минут до введения пенициллина, пациентам делали внутривенные вливания либо специфического анти-TNF-Fab (20 пациентам), либо контрольных Fab (19 пациентам), либо изотонического физиологического раствора (10 пациентам). JHP-реакции (которые клинически проявлялись в виде озноба) наблюдались у 10/20 пациентов, которым вводили специфические Fab, по сравнению с 26/29 пациентами группы контроля (p < 0,01). По сравнению с контрольными группами, у группы, получившей анти-TNF-Fаb, максимальное повышение температуры, частоты пульса, и систолического кровяного давления во время JHP был значительно более низкими (p < 0,01, < 0,0001, < 0,01, соответственно). Были проведены эксперименты, в которых участвовали пациенты, находящиеся в клинике Black Lion Hospital или в близлежащих клиниках, в том случае, если в их мазках крови обнаружили спирохету Borrelia
Критерии исключения из эксперимента
1. Дети моложе 12 лет
2. Беременные женщины
3. Пожилые люди (в возрасте более 60 лет) или сильно ослабленные с тяжелыми клиническими симптомами других острых заболеваний, например, таких как гипотензия, заметная желтуха, сильное истощение, и другие признаки недостаточного питания, склонность к сильному кровотечению, наличие сыпи при тифе, признаки активного туберкулеза легких, или легочной консолидации, состояние комы, менингит, сердечные респираторные заболевания или кома и "порхающий" тремор, эпилептические приступы, зафиксированные в истории болезни, и очаговые неврологические симптомы. 4. Пациенты с продолжительным сильным ознобом, гипотензией, или гипертермией, и другими симптомами спонтанной реакции ("кризис"). 5. Пациенты, принимающие другие антибиотики. К исследованиям и лечению допускались только те пациенты, которые давали свое информированное согласие на данные исследования и лечение. Исходная информация
История болезни, включая продолжительность и спектр симптомов, а также предварительное обследование физического состояния организма были зарегистрированы в соответствии со стандартной pro forma. Исследования
Пациенту в переднюю локтевую вену вводили политетрафтороэтиленовую канюлю, снабженную трехходовым вентилем, и пациента выдерживали на гепаринизированном физиологическом растворе. Брали пробы крови для анализа на микрогематоциты, на полное число лейкоцитов (WBC), число спирохет, уровни билирубина, ферментов печени, креатинин, или мочевины. Гемокультуру исследовали для обнаружения ассоциированных бактериальных инфекций (особенно тифозных). Как минимум 30 пациентов и как максимум 50 пациентов было произвольно отобрано для введения им внутривенно либо Fab-фрагментов овечьего поликлонального иммуноглобулина против TNF (ATNF-Fab), или идентичного на вид плацебо (контрольные Fab). 10 пациентов получали лишь изотонический физиологический раствор. Рано утром в день исследований, пациенты комфортно лежали в постели. Температуру измеряли с помощью электронного ректального термометра. Регистрировали также давление крови, частоту пульса и частоту дыхания. Обработка
Пациентам, чьи первоначальные ректальные температуры не изменялись более чем на 0,5 o C в течение 30 минут, вводили путем медленного (в течение 30 минут) внутривенного вливания 100 мл ATNF-Fab или контрольных Fab (содержимое сосудов, а именно 4 1,5 г лиофилизованного суммарных Fab, растворенных в 10 мл воды для инъекций, и разведенных до 100 мл изотоническим физиологическим раствором) или 100 мл изотонического физиологического раствора. Эта доза суммарных Fab-фрагментов иммуноглобулина соответствует дозе приблизительно 120 мг/кг, которая содержит около 20 мг специфических анти-TNF Fab. После завершения 30-минутного вливания, пациентам вводили внутримышечно (в переднюю мышцу бедра, разделенного на два участка, если это необходимо) стандартное противомикробное средство, а именно 600 000 ед. прокаинпенициллина. Oценка
Ректальные температуры, кровяное давление, частота пульса, частота дыхания и симптомы регистрировали в следующие интервалы времени (O = введение пенициллина): -60, -45, -30, 0, 15, 30, 45, 60, 75, 90, 105, 120, 150, 180 мин; 4,8 и 24 ч. Венозную кровь для подсчета числа спирохет, числа WBC (лейкоцитов), и числа цитокинов (TNF , 1L - 1 ; 1L - 8 и 1L - 6) брали в следующие интервалы времени: -30, 0, 60, 90 мин; 2, 4, 8 и 24 час. На протяжении всего эксперимента, пациентам разрешали пить. Сильная реакция JHP ожидалась через 60-90 минут после введения пенициллина. Материалы и методы
TNF-специфические овечьи полные Fab-фрагменты, используемые в клинических испытаниях, получали в соответствии со следующими процедурами:
Иммуноген
Антитоксин к TNF представлял собой Fab-фрагмент, продуцированный путем иммунизации овцы рекомбинантным чел. TNF (hr TNF),Hr TNF, продуцировали в E. coli путем экспрессии синтетического гена, сконструированного на основе известной кДНК, кодирующей чел. TNF (коммерчески доступный продукт, поставляемый Britich Biotechnology). Рекомбинантный белок, который имел молекулярную массу приблизительно 17,5 кДа, очищали до чистоты более чем 97%. Каждый пул иммуногена анализировали на чистоту, молекулярную массу, и цитотоксическую активность, а затем инъецировали овцам. Последний тест проводили путем анализа с использованием клеток L929 мышиной соединительной ткани. (i) Иммунизация
Группу из 10 овец иммунизировали путем подкожной инъекции на 6 участках. Иммунизацию проводили с убывающими дозами hr TNF, смешанного либо с полным, либо с неполным адъювантом Фрейнда, с последующими процедурами, осуществляемыми в соответствии со схемой иммунизации, описанной в примерах 1 и 2. Овец иммунизировали с интервалами времени в один месяц. (ii) Взятие образцов и проб крови
Через две недели после каждой иммунизации, у овец либо брали образцы для анализа (5 мл), либо брали пробы крови (500-700 мл) из яремной вены. Пробы крови переносили в стерильные апирогенные сосуды, оставляли для свертывания (в случае 5 - мл образца), или слегка вращали для стимуляции и более быстрого свертывания (в случае проб крови). Сгусток крови центрифугировали, а сыворотку (в виде супернатанта) отсасывали через стерилизующие (0,22 мкм) фильтры в гамма-облученные полиэтиленовые пакеты. (iii) Оценка образцов/проб крови
Через 6 и 22 недели после первичной иммунизации, для каждой овцы из группы оценивали титр антител с использованием простого твердофазного иммуноферментного анализа (ELISA). TNF связывали при высоком pH (9,6) с 96-луночным планшетом для твердофазного иммуноферментного анализа, и инкубировали с возрастающими разведениями сыворотки. hr TNF-специфические антитела в сыворотке связывались с планшетом, а несвязанные антитела затем удаляли путем промывания. Затем добавляли "второе" антитело, продуцированное в ослах и направленное против овечьих иммуноглобулинов, которое было конъюгировано с ферментом (пероксидазой хрена, HRP). В присутствии подходящего субстрата, HRP катализирует хромогенную реакцию, продукт которой является пропорциональным концентрации антитела в овечьей сыворотке. Затем образцы крови с титром более чем 1/30 000, объединяли с получением сывороточного пула от 10 овец. Овцы, которые не давали такого титра, были удалены из эксперимента. Отдельных овец не подвергали оценке после взятия образцов через 22 недели. (iv) Оценка сывороточного пула
Тесты на стерильность и содержание эндотоксинов осуществляли для каждого сывороточного пула, который, для использования его в изготовлении лекарственного средства, должен быть стерильным и содержать менее чем 1,25 э.ед/мл (э.ед. - эндотоксиновая единица - прим. пер.). Сбор пулов, и все последующие стадии осуществляли в чистом помещении в условиях класса 100. Каждый месяц пулы оценивали на титры с помощью ELISA, а также на концентрацию специфических антител с использованием мелкомасштабной аффинной очистки. Этот метод предусматривает пропускание иммунной сыворотки через аффинную колонку с небольшим количеством (1 г) hr TNFL-Сефарозы при селективной концентрации hr TNFL-специфических IgG. Эти IgG могут быть затем элюированы, и определена их концентрация. Для использования в изготовлении лекарственного средства, пулы должны содержать по крайней мере 2 г/л специфического антитела. (vi) Очистка иммуноглобулинов
Сывороточные фракции иммуноглобулина отделяли от других сывороточных белков, не представляющих терапевтической ценности, путем осаждения солью. Короче говоря, сульфат натрия (сорт USP 36%, 25 o C апирогенный и стерильный) в течение 15 минут при температуре 25 o C смешивали с объединенной сывороткой. Преципитат, полученный в результате этой процедуры, осаждали путем центрифугирования, а супернатант отсасывали. Затем осадок два раза промывали стерильным отфильтрованным раствором сульфата натрия (18%), концентрируя осадок после каждой промывки путем центрифугирования. Конечный осадок ресуспендировали в стерильном изотоническом (0,9%) солевом растворе, а затем фильтровали через стерильный фильтр (0,2 мкм). Анализ на стерильность и отсутствие эндотоксинов, а также титров проводили на данной стадии с использованием:
(I) теста на стерильность, USP (отсутствие 7-дневного роста)
(II) LAL-тест на эндотоксины
(III) Жидкостной экспресс-хроматографии белков методом гель-фильтрации (GF) (GF-FPLC)
(IV) Сравнения с необработанной сывороткой методом ELISA. Образцы, имеющие чистоту на 85% и титр на 85% больше, чем необработанная сыворотка, были использованы для продуцирования Fab. Концентрация иммуноглобулина на этой стадии составляла приблизительно 25 г/л, как показало измерение оптической плотности при 280 нм (с использованием коэффициента экстинкции 15,1% 280 нм для IgG). (V) Ферментный гидролиз
Fab-фрагменты иммуноглобулина получали путем инкубирования очищенного иммуноглобулина с растительным ферментом папаином, который сам по себе связывается с твердофазным носителем, что позволяет, после гидролиза, удалить фермент из гидролизной смеси. К IgG-препарату в присутствии восстановителя цистеина и EDTA (для сохранения ферментной активности) добавляли ферментную матрицу, и смесь оставляли на 24 часа при 37 o C для прохождения реакции гидролиза. По истечении этого времени, реакцию завершали путем центрифугирования смеси, в результате чего достигали две цели, а именно, удаляли из раствора иммобилизованный фермент, и избегали необходимости добавлять большие количества йодоацетамидного блокирующего агента. Затем раствор подвергали ультрафильтрации через 10 кДа-полисульфоновой ультрафильтр (содержащий предварительный фильтр из 0,45 мкм-стекловолокна), и промывали 10 объемами физиологического раствора (0,9%, стерильного и апирогенного) для удаления всех следовых количеств цистеина, EDTA, и любых Fc-фрагментов. Процедуры промывки обеспечивали уровни солевых примесей менее чем 2 млн.д. И наконец, стерильные апирогенные Fab-фрагменты фильтровали через стерилизующий 0,22 мкм-фильтр. На этой стадии брали образцы для оценки качества, а затем снова пропускали на GF-FPLC для контроля за эффективностью гидролиза, и после этого проводили также мелкомасштабную аффинную очистку для того, чтобы убедиться, что во время стадии гидролиза hr TNF-связывающая активность сохранилась на прежнем уровне. На этой стадии также осуществляли тест на стерильность и LAL-тест, и кроме того, проводили спектрофотометрическое определение концентрации. Концентрация Fab на этой стадии составляла приблизительно 60 г/л. В результате проведенных процедур, стерильные апирогенные (< 10 э.ед. /мл) образцы, которые указывали на полный гидролиз с образованием Fab (т.е. отсутствие интактного IgG), и которые по крайней мере на 85% по сравнению с исходной сывороткой сохраняли свою связующую способность, были готовы для заполнения флаконов. (vi) Заполнение флаконов
30-миллилитровые флаконы из нейтрального боросиликатного стекла наполняли 6,0 граммами Fab-раствора, и закрывали пробками из бутилкаучука. Затем сосуды замораживали при -70 o C в течение по крайней мере 30 минут, и переносили в стерильную сублимационную сушилку. В этой сушилке, сосуды выдерживали по крайней мере 48 часов, а затем герметично запаивали под вакуумом. Для инъекций, содержимое флаконов разводили водой (10 мл). На осушенных Fab проводили следующие тесты:
(a) тест на полную USP-стерильность, LAL-тест, и тест на пирогенный кроличий эндотоксин. (b) тест на концентрацию белка в восстановленном содержимом флакона с использованием метода Кьельдаля для определения азота. (c) тест на остаточную влагу,
(d) тест на чистоту с использованием FPLC путем гель-фильтрации,
(e) тест на определение hr TNF-нейтрализующей способности посредством анализа на цитотоксичность с использованием клеток L929. QC-тест (тест на качество)
Осуществляли следующие тесты:
Тест для оценки чистоты с помощью жидкостной экспресс-хроматографии (FPLC). Тест на стерильность. Лимулюс-тест (проба с лизатом амебоцитов) (LAL) на пироген. In vivo
Испытание кроликов на пироген
Испытания на острую токсичность, проводимые на мышах и морских свинках. Все партии были рандомизированы для использования в испытаниях двойным слепым методом. Подсчет лейкоцитов
Общее количество WBC подсчитывали с использованием гемоцитомера для подсчета клеток крови
Спирохеты
Мазки крови окрашивали по методу Райта, и исследовали с использованием оптического микроскопа. Цитокины
TNF,1L-1, 1L - 8 и 1L - 6 определяли с помощью иммуноанализа. Наборы для иммунорадиометрического анализа в целях подсчета цитокинов закупали у фирмы Medgenix Diagnostics SA, B -6220
Результаты:
1. Тяжелая клиническая реакция наблюдалась после введения пациенту физиологического раствора в качестве контроля. После того, как количество спирохет упало сразу после введения пенициллина (время = 0), дыхание пациента участилось, а температура повышалась, достигая иногда около 107 o F. На этой фазе пациент становился особенно уязвимым и может умереть от очень высокой температуры. 2. В эксперименте участвовали два пациента, которые имели нормальную температуру до начала эксперимента. Затем, у пациента, получившего физиологический раствор, наблюдалось повышение температуры, тогда, как у пациента, получившего анти-TNF-Fab, температура оставалась постоянной (фиг. 7). 3. В эксперименте участвовали также два пациента, которые имели высокие температуры к началу эксперимента. У пациента, получившего физиологический раствор, наблюдалось повышение температуры, тогда, как у пациента, получившего анти-TNF-Fab-температура вообще не повышалась и резко снижалась до нормальной (фиг. 8). 4. Исследование 59. Уровень цитокинов (1L-6, TNF, 1L-8 и 1L-1) у пациентов, получивших физиологический раствор, не изменялся в интервалы времени между - 30 час. и 0 (0 = введение пенициллина). У большинства пациентов, уровни цитокинов достигали максимума через 4 часа. Исследование 027. Уровни цитокинов у пациентов, получивших конт. Fab, не показали изменения в интервалы времени между - 30 и 0 (0 = введение пенициллина). Максимальный уровень наблюдался через 4 часа. Исследование 004. Уровни цитокинов у пациентов, получивших анти-TNF-Fab, резко снижались, по сравнению с контролем, в интервалы времени между - 30 час. и O (0 = введение пенициллина). Уровень других цитокинов оставался на приемлемом уровне, либо показывал значительно более низкий пик. На фиг. 9 показаны средние максимальные уровни TNF для пациентов, которым были введены анти-TNF-Fab или контрольные Fab, и для пациентов, которым был введен физиологический раствор. Кроме того, в Таблице 2 показаны эквивалентные данные для 1L - 8 и 1L - 6. В Таблице 3 показаны приступы реакции Джарича-Херксхеймера у пациентов, которым были введены контроль в виде физиологического раствора, либо Fab-контроль, либо анти-TNF-Fab. После введения анти-TNF-Fab не наблюдалось умеренных (2+) и сильных (3+) реакций. Клинические проявления JHR в виде озноба наблюдались у 10/20 пациентов, получавших анти-TNF-Fab по сравнению с 26/29 пациентами, которые получали контроль (p < 0,01) У анти-TNF-группы наблюдались значительно более низкие уровни повышения температуры, частоты пульса, и систолического кровяного давления во время JHR, чем у пациентов контрольной группы (p < 0,01, p < 0,0001, и p < 0,01, соответственно). Пример 8: Введение пациентам, получившим ОКТЗ-лечение, анти-TNF-Fab-фрагментов
ОКТЗ продуцировали из посевного материала родительский гибридомы (ATCC CP 8001 (Американская коллекция типовых культур, 12301, Parklawn Drive, Rockvilles, MD 20852-1776, США). Иммуноглобулин очищали из асцита, и приготавливали препараты. Схема лечения с использованием ОКТЗ описана в Ortho Study Group (1985) N. Engl. J. Med. 313, 337 - 342. Схема лечения с использованием ОКТЗ заключалась в следующем: пациенту, страдающему от реакции отторжения трупного трансплантата почки, инъецировали 5 мг ОКТЗ в течение 2 - 4 мин (i. v.) и эти инъекции повторяли ежедневно в течение 10 или 14 дней (всего вводили 50 или 70 мг мышиного моноклонального антитела). (Поликлональная антисыворотка против T-лимфоцитов (которая не является аффинно-очищенной) может быть также введена путем внутривенного вливания, но в гораздо более высокой дозе (100 - 300 мг) и в течение более длительного периода (а именно, около 6 час.). Такие вливания также должны проводиться ежедневно в течение 10-15 дней). Во время первой инъекции ОКТЗ, практически каждый пациент страдал от тяжелых признаков и симптомов, включая повышение температуры (по крайней мере у 90% пациентов), головные боли, тошноту и рвоту. Fab-фрагменты получали как описано в примерах 3 или 7. Эндогенные уровни TNF составляли 1 мкг/л или менее, и ограничивались областью внеклеточной жидкости (около 15 л). Для ослабления действия возрастающих уровней TNF и шоковых симптомов, индуцированных ОКТЗ, дозу 5 мг или 10 мг анти-TNF-Fab-фрагментов вводили в то же самое время, что и первую дозу ОКТЗ. Перед введением ОКТЗ и анти-TNF-Fab-фрагментов, пациентам вводили иммунодепрессанты, а именно, суточные дозы 1,0 мг/кг преднизолона и 142 мг/кг азатиоприна. После начала введения ОКТЗ и анти-TNF-Fab-фрагментов, пациентам вводили суточные дозы 0,6 мг/кг преднизолона и 30 мг/кг азатиоприна.
ФОРМУЛА ИЗОБРЕТЕНИЯ
1. Способ нейтрализации TNF у пациента, нуждающегося в такой нейтрализации, отличающийся тем, что указанному пациенту вводят IgG - Fab-фрагмент, обладающий реактивностью по отношению к TNF, а указанный Fab-фрагмент происходит от поликлонального IgG. 2. Способ по п. 1, отличающийся тем, что указанный пациент страдает септическим шоком или имеет симптомы септического шока. 3. Способ предупреждения или частичного ослабления септического шока или симптомов септического шока у пациента, отличающийся тем, что указанному пациенту вводят IgG - Fab-фрагмент, обладающий реактивностью по отношению к TNF, а указанный фрагмент происходит от поликлонального IgG. 4. Способ по п.2 или 3, отличающийся тем, что симптомы септического шока вызваны введением моноклонального антитела ОКТЗ или функционального эквивалентного антитела. 5. Способ по п.2 или 3, отличающийся тем, что симптомы септического шока вызваны реакцией Джарича-Херксхеймера. 6. IgG - Fab-фрагмент, являющийся реактивным по отношению к TNF и предназначенный для использования его в медицине, происходит от поликлонального IgG. 7. IgG - Fab-фрагмент по п.6, отличающийся тем, что его применяют в изготовлении лекарственного средства для лечения пациентов, нуждающихся в нейтрализации TNF.8. IgG - Fab-фрагмент по п.7, отличающийся тем, что указанный пациент страдает септическим шоком или имеет симптомы септического шока. 9. Фармацевтическая композиция, содержащая IgG - Fab-фрагмент, облладающий реактивностью по отношению к TNF, и физиологически приемлемый носитель, где указанный Fab-фрагмент происходит от поликлонального IgG. Приоритет по пунктам.
За сотни тысяч лет эволюции иммунная система выработала множество инструментов для сражений с патогенами. Один из главных - антитело: белок, способный необычайно избирательно связываться с характерными кусочками молекул - антигенами. Несколько десятилетий назад биологам удалось «приручить» антитела: научиться производить их к нужным антигенам в любом количестве. И это открыло новую страницу в молекулярной биологии: появились иммунологические методики. Благодаря им мы можем «поймать» в растворе, клетке или срезе ткани почти любые молекулы и понять, сколько их, где именно они находятся и как взаимодействуют с другими молекулами.
Генеральный партнер цикла - компания : крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Партнер этой статьи - GE Healthcare

Если говорить совсем точно, то антиген - это не всегда целая молекула, а иногда просто характерный кусочек молекулы.
В какой-то момент ученые поняли, что если антитела умеют специфично узнавать различные антигены, то можно это их свойство использовать в собственных, научных интересах. Так исследователи в своих лабораториях стали получать антитела с заданной специфичностью - очень избирательно узнающие один, определенный, нужный исследователям антиген, и ничего больше. И это стало огромным прорывом.
Представьте, например, что нам нужно исследовать опасный белок, который вырабатывают только раковые клетки и не вырабатывают здоровые. Антитело к этому белку - своеобразная «удочка», которая ловит только его и никого больше. Выловив на антительный «крючок» нехорошую молекулу, мы можем внимательно ее изучить, сделать какие-то важные выводы о ее функционировании, определить концентрацию, попытаться найти слабые места, чтобы в дальнейшем сделать против нее лекарство. Можем обнаружить все производящие ее клетки (в нашем случае - раковые!) - их распространение, количество и так далее.
Можно антитела использовать и для других, более сложных, целей. Например, к ним можно «пришивать» разноцветные флуоресцентные молекулы, а потом «сажать» на соответствующие антигены. В результате эти антигены станут светиться, и мы сможем изучать взаимодействия важных молекул даже в живой клетке. Также использование антител позволяет изучать и такие белки, которые связаны с ДНК и оказывают непосредственное влияние на процесс транскрипции.
Как правило, методы, которые в качестве инструментов используют антитела, несут в своем названии приставку «иммуно-»: иммунопреципитация, иммунохроматография, иммуноферментный анализ (рис. 1). Именно о таких методах мы и расскажем в этой статье.

Рисунок 1. Несколько вех на пути развития иммунологических технологий.
1890 г.
- Беринг и Китазато открыли антитела - один из основных компонентов иммунного ответа организма. 1937 г.
- Тиселиус и Кабата начали изучать молекулярную структуру антител. 1941 г.
- Альберт Кунс разработал метод иммуногистохимии . С тех пор метод прошел множество модификаций и усовершенствований, однако принцип его работы остался неизменным. 1966–1969 г.
- Стратис Аврамис разработал методику пришивания ферментов к антителам (чуть позже вы поймете, насколько это важно) . 1971 г.
- Питер Перлман из Стокгольмского университета и Антон Шурс из Нидерландов независимо друг от друга разработали метод иммуноферментного анализа , . 1975 г.
- Сезар Мильштейн и Жорж Келер разработали метод гибридом - методику промышленного получения антител к определенному антигену (моноклональных антител). 1979 г.
- Гарри Тобин из Института Фридриха Мишера разработал метод вестерн-блоттинг . 1985 г.
- Джордж Смит разработал методику фагового дисплея . Позднее, в 1990-х годах, ее оптимизировали другие исследователи. 1999 г.
- Разработали метод ChIP-chip для определения распределения когезина вдоль хромосомы III у делящихся дрожжей . 2007–2008 г.
- Появился и вошел в обиход метод ChIP-sequence .
Чтобы увидеть рисунок в полном размере, нажмите на него.
Действующие лица
В этом разделе мы представляем вам главные молекулы-инструменты, используемые в иммунологических методах.
Антитела
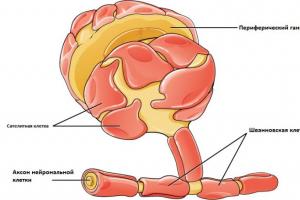
Антитело, или иммуноглобулин, - это крупный белок, состоящий, как правило, из двух тяжелых и двух легких цепей. Тяжелые и легкие цепи, в свою очередь, состоят из вариабельных (V) и константных (С) доменов . Тяжелые цепи содержат один вариабельный (VH) и три константных домена (СH1, СH2, СH3), легкие цепи - один вариабельный (VL) и один константный (СL) домены (рис. 2) . Именно такое строение обеспечивает способность антител узнавать конкретные антигены (это называется вариабельностью антител и осуществляется V-доменами) и взаимодействовать с клетками собственной иммунной системы (эффекторная функция антител; за нее ответственны C-домены).

Рисунок 2. Строение антитела. Вариабельные домены легкой и тяжелой цепей (VH и VL) вместе с ближайшими к ним константными доменами (CH1 и CL1) образуют Fab-фрагменты антител (fragment antigen binding ). Именно этими фрагментами антитело «цепляется» за свой антиген. Остальную часть, представленную C-концевыми константными доменами тяжелых цепей, обозначают как Fc-фрагмент (fragment crystallizable ), которым антитело может цепляться за Fc-рецепторы , расположенные на некоторых иммунных клетках. На границе Fab и Fc фрагментов располагается гибкая «шарнирная область», благодаря которой фрагменты антитела могут двигаться друг относительно друга; эта область содержит дисульфидные связи, соединяющие тяжелые цепи между собой.
Каждое антитело распознает свой антиген и только его. А вот на каждый антиген может быть множество разных антител, которые распознают разные его участки (эпитопы ). Разные антитела на один антиген называются поликлональными , то есть, состоящими из множества клонов - популяций антител. А идентичные друг другу, одинаковые молекулы антител называют моноклональными . Поликлональные антитела куда дешевле и проще в производстве, чем моноклональные, но в иммунологических методиках чаще используют моноклональные, потому что они - абсолютно одинаковые молекулы, они гарантированно распознают один и тот же участок одного и того же антигена и потому гораздо стабильнее ведут себя в иммунологических методиках.
Антитело по своей структуре - эдакий Тянитолкай. С одной стороны у него находится связывающая антиген область (Fab-фрагмент), с другой стороны - «хвосты» тяжелых цепей - Fc-фрагмент. И для некоторых задач исследователю выгодно использовать не всё антитело, а лишь какую-то его часть. Так, можно взять Fc-фрагмент и пришить к нему какую-то другую молекулу (например, главный комплекс гистосовместимости (MHC)). Это увеличит время жизни молекулы в сыворотке крови и позволит связываться с рецепторами для антител (Fc-рецепторами). А можно использовать лишь Fab-фрагмент или комбинировать Fab-фрагменты различной специфичности, создавая так называемые биспецифические антитела. Кроме того, можно использовать не весь Fab-фрагмент, а лишь пару вариабельных доменов антитела и также . На рисунке 3 представлены различные варианты таких конструкций.

Рисунок 3. Конструкции на основе комбинаций фрагментов антител. Исходные антитела нарисованы слева сине-зеленым и оранжево-розовым . Пояснения - в тексте.
Их фрагменты и комбинации представляют собой:
- Fab - отдельно применяемый антигенраспознающий фрагмент антитела.
- F(ab’) 2 - двойной антигенраспознающий фрагмент антитела с кусочком шарнирного участка.
- Fab’ - антигенраспознающий фрагмент антитела с кусочком шарнирного участка. Эти три молекулы меньше размером, чем целое антитело, и поэтому более «юркие», лучше проникают в ткани и в некоторых случаях работают лучше полноценных антител. Такие фрагменты получают из целых антител, разрезая их специальными ферментами.
- scFv - одноцепочечный вариабельный фрагмент - только сам антигенраспознающий участок антитела, ничего лишнего. Он модифицирован так, чтобы состоять из одной белковой цепи, а не из двух, как в антителе. Благодаря этому scFv не требует сложной посттрансляционной сборки, и его можно производить в бактериальных клетках, а это - самый простой и дешевый способ биотехнологического производства. Очень легкая и удобная молекула для иммунологических методик.
- di-scFv - двойной одноцепочечный вариабельный фрагмент. То же, что предыдущее, только в двойном экземпляре. Работает чуть активнее, но и весит в два раза больше.
- sdAB - однодоменное антитело . Самая миниатюрная молекула из всех присутствующих. Представляет собой только вариабельный участок тяжелой цепи особых антител, которые наряду с классическими антителами присутствуют в крови у верблюдовых и у некоторых видов хрящевых рыб. Также можно получать sdAb, разделяя димерный вариабельный домен классического антитела на меньшие по размеру мономеры. Такие молекулы легки в производстве и неплохо работают.
- Трифункциональное антитело - представляет собой «химеру» из двух разных антител и имеет три сайта связывания: антигена 1, антигена 2 и Fc-рецептора.
- Химически связанное F(ab) 2 - сшитые между собой Fab-фрагменты двух разных антител.
- BiTE (Bi-specific T-cell engager ) - очень изящная искусственно выработанная молекула, представляющая собой одну белковую цепь, которая после трансляции сворачивается в два вариабельных участка двух разных антител.
Ловушки для антител
Для многих иммунных методик важно надежно закрепить молекулы антител на каком-то твердом носителе. Этих носителей есть несколько типов (рис. 4):
- Агароза - полисахарид, который получают из красных и бурых водорослей. Агароза умеет полимеризоваться в плотную структуру, которую называют гелем или смолой. После некоторых манипуляций агарозную смолу можно превратить в прекрасную «ловушку» для антител - сделать так, чтобы они крепко на нее налипали.
- Магнитные частицы - это наночастицы, основу которых составляет магнитный материал, например, оксид железа. Если на поверхность частицы поместить функциональные группы (например, NH 2 или COOH), они смогут связывать антитела. Поэтому магнитные частицы также часто используют для иммобилизации антитела на своей поверхности наряду с агарозой.
- Нитроцеллюлозная мембрана - носитель, который за счет гидрофобных взаимодействий может удерживать на себе белки и пептиды.
- Мембрана из поливинилиденфторида (PVDF) - высокогидрофобный носитель, который также может удерживать на своей поверхности белки и пептиды.
- Планшеты из полистирола - также состоят из высокогидрофобного материала, удерживающего на своей поверхности белки и пептиды. Как правило, для нужд иммунохимии используют 96-луночные планшеты с плоским дном (flat-bottom plates ). Кроме того, нередко такие планшеты обрабатывают стрептавидином, который может связаться с биотином, присоединенным к Fc-концу антител, и таким образом крепко-накрепко привязать антитела к внутренней поверхности лунок планшета.
Как увидеть антитела
Антитела - это бесцветные белки, и сами по себе увидеть их в реакционной смеси невозможно. Поэтому если мы что-то пометили антителами, то эти самые антитела нам потом нужно как-то визуализировать, сделать видимыми. Для этого есть несколько остроумных способов (рис. 5).
Фермент и субстрат
Можно пришить к антителу какой-нибудь фермент, катализирующий «цветную» химическую реакцию. Обычно это пероксидаза хрена или щелочная фосфатаза . Теперь, когда мы добавляем в реакционную смесь субстрат используемого фермента (DAB или BCIP /NBT соответственно), то, если там есть антитело с пришитым к нему ферментом, субстрат расщепится, произойдет «цветная» реакция, и по изменению цвета реакционной смеси мы сможем понять, есть ли в этой смеси фермент и сколько его - а значит, и сколько там антител.
Флуоресцентная метка
Можно не заморачиваться с двухэтапной системой «фермент-субстрат» и сразу пришить к антителу цветную флуоресцентную метку . Правда, в этом случае, чтобы увидеть результат, нам придется использовать флуоресцентный микроскоп .

Рисунок 5. Визуализация антител. Слева : к антителу пришит фермент , катализирующий «цветную» реакцию (то есть, такую, в которой субстрат меняет цвет). И чтобы узнать, есть ли в смеси эти антитела, достаточно добавить в эту смесь субстрат для данного фермента. Если смесь поменяла цвет - значит, антитела есть. Измерив с помощью спектрофотометра , насколько смесь поменяла цвет, можно определить и количество антител. Справа : антитела с пришитыми к ним флуоресцентными метками можно увидеть с помощью флуоресцентного микроскопа и определить, где эти антитела находятся и в каких количествах. К тому же, это очень красиво .
Иммунологические методы
А теперь, когда мы овладели всей подготовительной информацией, пришло время перейти собственно к иммунологическим методикам.
Иммунопреципитация и коиммунопреципитация
Уникальное свойство антител - возможность налипать только на соответствующие антигены - делает их своего рода «волшебными магнитами» в руках биотехнолога. С помощью антител можно обнаруживать нужные молекулы (как правило, белки) среди ненужных; выделять эти нужные молекулы, очищать их, определять их количество и так далее. Методы, основанные на использовании антител, можно применять и для изучения сложной белковой смеси, или, говоря научным языком, протеома . Рассмотрение иммунных методов мы начнем с одного из самых простых - иммунопреципитации .
Иммунопреципитация - способ, с помощью которого можно выделить из смеси и осадить (precipitate ) ту молекулу, которая нас интересует (как правило, это белок; назовем его «Белок Х» ).
Последовательность действия при иммунопреципитации такова (рис. 6):
- Получаем антитела к нашему Белку Х (о том, как это сделать, подробно рассказано в разделе «Фабрика инструментов»).
- Закрепляем эти антитела на каком-нибудь твердом носителе , как правило, агарозной смоле (см. раздел «Ловушки для антител»). А в последнее время все чаще используют магнитные частицы - они очень удобны, их можно с помощью обычного магнита отделить от раствора. «Пришивание» антитела к носителю - отдельная тема: для этого можно сперва облепить носитель специальными белками ( и ), которые умеют крепко связываться с Fc-участком антител (рис. 2), а можно использовать специальную агарозу, которая «ловит» антитела на торчащие альдегидные группы (рис. 3).
- Помещаем антитела на носителе в исследуемый раствор (таким раствором могут быть, например, перемолотые клетки - лизаты, или плазма крови), чтобы на антитела налипли молекулы Белка Х (и только они!).
- Выуживаем носитель с антителами и налипшими на них молекулами Белка Х (чем-то это напоминает сказку про репку, где бабка тащила за дедку, а внучка - за бабку), промываем от ненужных молекул и элюируем (то есть, с помощью специального буфера отлепляем от антител и собираем в отдельной пробирке).
Коиммунопреципитация похожа на иммунопреципитацию, только немного сложней. Она предназначена для выделения антигена вместе с белками, которые с ним связаны. В таких случаях известный антиген называют белком-приманкой (bait protein ), а белки, с которыми он взаимодействует, белками-жертвами (prey protein(s) ). Жертвами могут быть структурные белки, сигнальные молекулы, кофакторы и т. д.
Анализ белок-белковых взаимодействий со скоростью света!

Метод иммунопреципитации используют также при проведении анализа белков с использованием (bio-layer interferometry , BLI ), позволяющей не только определять количество целевых макромолекул в растворе, но и анализировать взаимодействие лигандных молекул с молекулами-рецепторами в динамике.
Система Biacore T200 позволяет получить надежные данные о кинетике, сродстве, концентрации, специфичности, селективности и термодинамических свойствах исследуемых взаимодействий в режиме реального времени.
Производительность и универсальность Biacore T200 позволяют использовать ее для широкого спектра приложений:
- изучение молекулярных механизмов и структурно-функциональных особенностей взаимодействий различных биомолекул;
- характеристика и оценка эффективности биотерапии;
- поиск соединения-прототипа при создании новых лекарств и его оптимизация;
- обнаружение и характеристика противолекарственных антител (ADA), способных нейтрализовывать терапевтический эффект препарата и/или изменять его фармакокинетику (при исследованиях на иммуногенность).
Компания GE Healthcare поддерживает проведение ежегодной школы по плазмонному резонансу в Москве: «В Москве прошла научная школа „Применение SPR-биосенсоров Biacore в разработках лекарств“ » .
* - «Биакор».
Материал предоставлен партнёром - компанией «GE Healthcare»
Иммуноферментный анализ

Вестерн-блоттинг
- На мембрану на некотором расстоянии друг от друга нанесены: а) антитела к Белку Х, к которым пришита метка, - так называемые первичные антитела (меткой могут быть окрашенные латексные шарики, коллоидное золото, флуоресцентный белок и т.п.);б) еще одни антитела, специфичные к Белку Х (тестовая полоса ) и, наконец, в) антитела к первичным антителам (контрольная полоса ).
- Мембрану погружаем одним концом в исследуемую жидкость, с током которой Белок Х (если он, конечно, присутствует в пробе) передвигается сначала к антителам с меткой, связывается с ними и движется дальше к тестовой полосе.
- На тестовой полосе комплекс антиген-первичное антитело связывается с присутствующими там антителами, закрепляется и окрашивает ее.
- Избыток первичных антител, смытый с их места дислокации, движется дальше, к контрольной полосе, где связывается с присутствующими там антителами, останавливается и окрашивает ее.
- Расшифровка результатов проста: если в анализируемой жидкости есть Белок Х, то на тесте будут видны две полосы, если же белка нет - только контрольная полоса.
Широко распространенный пример использования иммунохроматографии - тесты для определения беременности. Исследуемой жидкостью в них выступает моча женщины, в которой присутствует белок хорионический гонадотропин человека (ХГЧ) - гормон, вырабатывающийся тканью хориона после имплантации эмбриона в стенку матки. ХГЧ движется по тест-полоске, в результате чего на ней появляются две полосы - это означает, что тест положителен, и женщина беременна.
Иммуногистохимия
Многие антигены ученым и врачам хотелось бы определять не в сыворотке крови или в других жидкостях, а прямо на исследуемых тканях. Например, на опухолях. Ведь важно знать, экспрессируется ли на онкологической ткани тот или иной антиген: таким образом можно определить тип опухоли, предположить характер ее метастазирования и так далее. Способ, с помощью которого можно «увидеть» антигены на целой ткани, называется иммуногистохимией .
Она очень часто используется в медицинской диагностике, помогая врачам определить принадлежность опухоли к тому или иному типу и подобрать необходимое лечение . Еще ее часто используют, чтобы диагностировать онкологические и иммунологические заболевания. Ученые иммуногистохимией тоже не пренебрегают. Например, с ее помощью можно определить, начался ли в ткани апоптоз, или исследовать нейродегенеративные заболевания .
Вот как проводят иммуногистохимию (рис. 10):
- Для начала исследователю необходимо выбрать орган, ткань которого он хочет исследовать. После этого орган извлекают и специальным образом подготавливают.Обычно ткань замораживают или же заключают в парафин . Суть этой подготовки в том, чтобы орган можно было тонко нарезать и закрепить на специальном стекле, на котором будет происходить исследование. Толщина среза при этом должна быть не более 18 микрон , иначе исследователь рискует при гистохимии ничего не увидеть.
- После того, как тонко нарезанная ткань оказалась на стекле, производят уже много раз встречавшуюся нам «забивку» - блокировку неспецифических антигенов, как правило, с помощью бычьего сывороточного альбумина. Когда процесс блокировки завершен, можно приступать к определению тканевых антигенов. Обычно для этого используют поликлональные или моноклональные антитела. Кроме того, иммуногистохимия может проходить в две или одну стадии - с использованием вторичных антител (непрямая иммуногистохимия ) или без них (прямая иммуногистохимия ).
- При прямой иммуногистохимии с антигеном на тканисвязываютсяпервичные антитела с флуоресцентной меткой. При непрямой иммуногистохимии флуоресцентную метку на себе несет вторичное антитело, которое связывается с противоположным от ткани концом первичного антитела.
- После завершения всех процедур используют флуоресцентный микроскоп, чтобы увидеть свечение, если на ткани присутствует антиген. Наличие антигена можно определять не только при помощи флуоресцентной метки, но и с помощью системы «фермент-субстрат», о которой мы уже говорили в разделе «Как увидеть антитела» .
Помимо иммуногистохимии существует еще один метод с похожим принципом действия - иммуноцитохимия . Как можно заключить из названия, разница в том, что антигены определяют не на ткани, не на поверхности ее клеток, а непосредственно внутри клеток, то есть, отыскиваются внутриклеточные антигены. Для этого исследуемые клетки надо пермеабилизировать - то есть продырявить им мембрану, - а в остальном .
Иммуногисто- и иммуноцитохимия - это очень удобные методы для медицинской диагностики и научных исследований, при помощи которых можно отличать друг от друга ткани по внутри- и внеклеточным антигенам.
Реагенты для иммуно-гистохимического окрашивания:
- и (конъюгированные), Abcam
- , Abcam
- Растворы для разведения антител
- Растворы для депарафинизации срезов

Справочники, видеолекции, протоколы:
- «Реагенты для ИГХ » (справочник, англ., Abcam , 2017, 48 стр., 3 Mb)
- «Флуоресцентное окрашивание, реагенты » (руководство,русск., Abcam , 22 стр., 2 Mb)
- «Как выбрать вторичные антитела » (англ., Abcam , 12 стр., 5 Mb)
- «Оптимизация иммуноцитологического и иммуногистологического метода окрашивания » (вебинар)
- «Методы окраски ИЦХ/ИГХ с использованием и нескольких флуоресцентных меток » (вебинар)
Материал предоставлен партнёром - компанией «Диаэм»
ChIP-сhip и ChIP-seq
Эти методы нужны для выяснения, с какими последовательностями ДНК в клетке связываются исследуемые белки (например, гистоны) . Методы очень похожи, и отличаются только последним этапом. ChIP расшифровывается как chromatin immunoprecipitation , то есть иммунопреципитация хроматина .

Рисунок 11. Проведение анализа . Первым делом Белок Х связывается с геномной ДНК, после чего ДНК во всей клетке расщепляется при помощи ультразвука. Для иммунопреципитации искомого белка добавляются полимерные шарики с антителами к нему. После нескольких стадий отмывки белок отсоединяется от ДНК, и ее анализируют при помощи секвенирования для определения нуклеотидной последовательности, которая связывается с Белком Х.
Антитела - чрезвычайно капризный материал для биотехнологического производства. Во-первых, они состоят из двух типов цепей, а, во-вторых, содержат в своей структуре несколько дисульфидных связей, которые могут быть построены только специальными ферментами. Поэтому производство полноразмерных антител - дело не из легких, и с ним справится далеко не каждая система экспрессии рекомбинантных белков .
95% применяемых в клинике антител производится в клеточных линиях млекопитающих. Это дорого и долго, но другого выхода нет - только клетка млекопитающего хорошо понимает, как именно провести посттрансляционную модификацию полноценного антитела. Есть несколько клеточных линий, которые могут продуцировать антитела. Самые известные из них - клетки яичника китайского хомячка (chinese hamster ovary , CHO ) и линия человеческой эмбриональной почки (human embryonic kidney , HEK293 ). Они пригодны как для получения линии, стабильно экспрессирующей нужное антитело, так и для производящей продукт лишь некоторое время (транзиентная экспрессия).
При этом фрагменты антител (Fab, scFv и так далее) вполне можно производить и в других биотехнологических системах, прежде всего, бактериальных: эти фрагменты достаточно маленькие, чтобы их ген влез в бактериальную плазмиду, и к тому же их не надо посттрансляционно модифицировать - бактерии этого делать просто не умеют. Помимо бактерий, производить фрагменты антител могут дрожжи, нитчатые грибы и линии клеток насекомых.
Для получения антител можно использовать и целые организмы - так называемые трансгенные растения и животные. Растения немного отличаются от животных по паттернам гликозилирования, поэтому для того, чтобы синтезированные растительной клеткой белки тяжелой и легкой цепи антитела правильно соединились между собой, ученым приходится применять множество сложных уловок. Тем не менее использование трансгенных растений существенно снижает себестоимость получения антител, и хотя сейчас на рынок еще не вышло ни одно антитело, произведенное таким образом, несколько из них уже проходят клинические испытания .
Еще одна заманчивая перспектива для производства антител - использование трансгенных животных, ведь в этом случае нужные нам белки можно будет получать, например, в молоке мышей, кроликов, коров и овец или даже в яйцах кур. В настоящее время такой способ получения антител активно исследуется, однако пока он далек от реального использования в медицине , .
Фаговый дисплей
Фаговый дисплей (рис. 14) - это, строго говоря, не метод наработки антител, а лишь подготовительная методика для их промышленной наработки, а именно, получения векторных вставок для последующего биотехнологического производства (о котором мы только что рассказали).
Метод основан на работе бактериальных вирусов - бактериофагов. Суть метода заключается в следующем факте: если в ген, который отвечает за синтез оболочки бактериофага, встроить ген какого-либо другого белка, то фаг будет «отображать» (display ) этот другой белок на своей поверхности. Если фагов с разными генами много, мы получаем фаговую библиотеку. Фаговая библиотека антител представляет собой популяцию бактериофагов, каждый из которых несет на себе либо Fab-фрагмент антитела, либо sdAb. Существует несколько типов фаговых библиотек. Библиотеки на основе ДНК иммунных клеток здоровых людей называются наивными . Сфокусированные библиотеки создают из клеток иммунизированного животного. В этом случае происходит увеличение числа вариантов антител к антигену, которым иммунизируют животных. Синтетические библиотеки состоят из генов, синтезированных искусственно .
Разберем схему фагового дисплея на примере сфокусированной библиотеки (рис. 14).
- Иммунизируем животное тем антигеном, к которому хотим получить антитела.
- Отбираем у животного кровь и выделяем из нее B-лимфоциты.
- Из этих клеток клонируем последовательность всех генов антител, для чего выделяем из них РНК и на ее основе синтезируем комплементарную ДНК.
- Встраиваем полученную последовательность комплементарной ДНК в геном фага.
Библиотека получена, но в ней находится очень много фагов. Многие из них несут антитела к неспецифическим мишеням, которые не представляют интереса для исследователя - ситуация такая же, как и в вышеописанном методе гибридом. Исследователь получает сонмище антител, из которых ему нужно выделить те, которые узнают целевой антиген. И здесь снова потребуются селекции. - Чтобы вытащить из библиотеки только те бактериофаги, которые несут на своей поверхности специфический белок, их инкубируют с антигеном - если на фаге есть нужное антитело, то он окажется крепко связанным с антигеном.
- Несвязавшиеся фаги легко смываются...
- ...а оставшиеся отделяют от антигена...
- ...и заражают ими бактерии.
Бактерии активно делятся, и, соответственно, в них также увеличивается и количество необходимых вирусов. В новой фаговой библиотеке неспецифических молекул будет еще меньше, и, повторяя селекцию несколько раз, можно избавиться от них практически полностью. В результате останутся только те фаги, которые несут на своей поверхности нужные фрагменты белков. - Из этих оставшихся фагов извлекают ДНК, определяют нуклеотидную последовательность, и клонируют ее в бактериальный или иной вектор для последующих получения и наработки антител, о чем рассказано в разделе «Биотехнологическое производство в эукариотических рекомбинантных системах» .
Несколько слов об аптамерах
Как ни парадоксально это звучит, но иммунные методики не ограничиваются исключительно использованием иммунных молекул - антител. «Ловить» белковые молекулы можно и с помощью особым образом подобранных нуклеиновых кислот - аптамеров .
Открытие структуры и механизмов биосинтеза основных полимеров живых клеток, а вместе с тем - регуляции генной активности, например, в формате оперонов, донесло до людей полезную мысль, что белки могут со значительным сродством связываться с определенными последовательностями нуклеиновых кислот, так называемыми мотивами . Многие белковые факторы транскрипции имеют свою характерную последовательность ДНК, с которой они связываются наиболее прочно, сохраняя слабое сродство к остальным участкам нуклеиновой кислоты. Разумеется, на выяснение того, с какими последовательностями связываются разные регуляторные белки, брошены существенные усилия исследователей, и здесь достигнуты значительные успехи .
Наблюдения за механизмами специфичного связывания белками нуклеиновых кислот породили обратную постановку задачи: а нельзя ли подобрать особую последовательность, связывающую произвольный белок? Было бы удобно использовать такую последовательность ДНК или РНК (особенно первую из-за более высокой химической стабильности), которую можно легко амплифицировать путем полимеразной цепной реакции для связывания интересующих нас белковых молекул. Если удастся достичь достаточно избирательного и прочного связывания, то такие последовательности нуклеиновой кислоты, наподобие антител, способны сослужить хорошую службу в методах качественного и количественного анализа белков.
Так разработали метод отбора связующих нуклеиновых молекул, которые назвали аптамерами. Метод назвали SELEX (от английского systematic evolution of ligands by exponential enrichment , то есть систематическая эволюция путем экспоненциального обогащения ), или просто селекцией in vitro , . Вначале осуществляют синтез фрагментов нуклеиновой кислоты, которые представляют собой набор случайных последовательностей, но каждая по краям содержит постоянные элементы, необходимые впоследствии для амплификации. Интересующий нас белок-мишень укрепляют на твердом носителе и дают получившейся смеси полинуклеотидов связываться с этой мишенью. Носитель тщательно промывают, а то, что осталось связанным на белке, амплифицируют путем ПЦР. По идее, ненужное мы отмыли, а оставшееся - это именно то, что хорошо связывается с нашим белком. Но для хороших аналитических характеристик связующего вещества ему еще нужно эволюционировать в пробирке. Циклы SELEX повторяют много раз, в ходе чего смесь обогащается наиболее прочно связывающейся последовательностью нуклеиновой кислоты. Ее можно отсеквенировать и затем синтезировать в любых нужных количествах.
Все здорово, правда? Насколько лучше по сравнению с трудностями получения антител! Однако в разработке аптамеров, конечно, имеется значительное количество подводных камней. Один из самых главных - химические свойства нуклеиновой кислоты. Поскольку это кислота, связываться она может только со щелочными белками. Если белок кислый или даже нейтральный, аптамер к нему подобрать, скорее всего, не удастся. Однако изощренный научный подход частично решает и эту проблему. Созданы аптамеры из нуклеиновой кислоты, содержащей не естественные азотистые основания, а химически модифицированные. Так одному из биотехнологических стартапов удалось получить хорошие аптамеры к более чем тысяче белков человека. Эти агенты назвали специальным словом - somamer . На основе сомамеров созданы чипы для полуколичественного анализа примерно тысячи белков плазмы крови . Их в последние годы часто используют в исследованиях для поиска биомаркеров. Чипы на основе сомамеров - хорошая альтернатива протеомике, использующей масс-спектрометрию.
Итак, аптамеры могут в ряде случаев заменять антитела. Их легче синтезировать, а детектирование связанных белков или даже других молекул осуществляется за счет амплификации связавшегося материала. Аптамеры, как и антитела, рассматривают в качестве лекарственных средств. Дошло до того, что одно из лекарств на основе аптамера, пегаптаниб , уже вышло на рынок и используется для лечения атрофии сетчатки глаза.
Заключение
1. Тема лекции: «Система гуморального иммунитета Дифференцировка В-лимфоцитов. Строение иммуноглобулина G»
2. Цель: Ознакомить студентов с основными функциямиВ-системы иммунитета, рассмотреть основные этапы дифференцировки В-лимфоцитов,строение и функции иммуноглобулинаG.
3. Тезисы лекции:
Основные функции В-системы.
Химическое строение иммуноглобулина G.
Функции Fab и Fc-фрагментов иммуноглобулинов
Система гуморального иммунитета – это специализированная система, главной функцией которой является синтез антител против антигенов. Функциональная активность системы гуморального иммунитета в большинстве случаев зависит от тесного взаимодействия с Т-системой иммунитета и антигенпредставляющими клетками.
Главными клетками системы гуморального иммунитета являются В-лимфоциты, ответственные за синтез антител. Участие антител в реализации гуморального иммунного ответа связано с образованием иммунных комплексов с растворимыми и корпускулярными антигенами. В составе иммунных комплексов антигены подвергаются изоляции и/или уничтожению.
Главной функцией антител является специфическое связывание антигена. Специфическое взаимодействие антигенов и антител основано на пространственном соответствии, или комплементарности, существующем между ними.
В молекуле IgGсодержится 4 полипептидные цепи: 2 тяжелые и 2 легкие. В непосредственный контакт с антигеном вступают аминокислоты так называемой гипервариабельной области V-доменов. Полость активного центра находится между вариабельными участками тяжелой и легкой цепей и по форме точно соответствует определенной гаптенной группировке. Фрагмент, содержащий постоянные домены обеих тяжелых цепей (2 СН 2 , и 2СН 3), называется Fc-фрагментом.
Основные функции Fab и Fc-фрагментов
Главная функция Fab-фрагмента - связывание антигена , т.к. в его состав входит активный антигенсвязывающий центр молекулы иммуноглобулина, сформированный V H и V L -доменами тяжелой и легкой цепей.
Функции Fс-фрагмента:
1. Разные классы иммуноглобулинов отличаются между собой по строению Fс-фрагментов. Эти различия могут касаться как количества СН-доменов, входящих в состав Fc-фрагментов, так и их аминокислотного состава (могут быть дополнительные домены, например, СН 4 у IgM и IgE). Благодаря различиям в строении Fc-фрагментов, классы иммуноглобулинов различаются и по функциям.
2. С помощью Fс-фрагментов происходит полимеризация молекул иммуноглобулинов. Например, секреторный IgA образует димеры и тримеры, сывороточный IgМ является пентамером.
3. В Fc-фрагментах IgМ, IgG 1 и IgG 3 при связывании с антигеном происходит структурное изменение, в результате которого в области СН 2 -домена возникает активный участок, связывающий первый компонент системы комплемента, поэтомуэти классы иммуноглобулинов у человека вызывают активацию системы комплемента по классическому пути .
4. С помощью Fс-фрагментов молекулы иммуноглобулинов встраиваются в плазматическую мембрану В-лимфоцитов и являются антигенраспознающими рецепторами .
5. На поверхности многих клеток организма имеются Fс-рецепторы к разным классам иммуноглобулинов . Если к этим рецепторам прикрепляются соответствующие иммуноглобулины или иммунные комплексы, в состав которых входят эти иммуноглобулины, точерез эти рецепторы может происходить активация или подавление функций соответствующих клеток .
4. Иллюстративный материал: мультимедийная лекция №2
Антитела (Ат) - эффекторные молекулы гуморального иммунитета. Синтез антител запускают Аг, поступающие в организм извне (при инфекциях, вакцинации, действии ксенобиотиков) или образующиеся эндогенно. Как правило, AT специфически взаимодействует с комплементарным Аг. Существуют, однако, антитела, взаимодействующие с Аг-детерминантами, общими для различных Аг. Такие антитела известны как перекрёстнореагирующие, или гетероспецифичные.
Антитела существуют в миллионах разновидностей, и каждая молекула имеет уникальный участок связывания Аг-детерминанты. В большинстве случаев антитела представлены сывороточными гликопротеинами , мигрирующими в составе медленной фракции гамма-глобулинов при электрофорезе белков сыворотки крови. Поэтому для обозначения сывороточной фракции AT иногда применяют термин «гамма-глобулины ».
Антитела также называют «иммуноглобулины» . Антитела (Ат) образуют одну из основных фракций белков крови, составляя 20% массы общего белка плазмы. AT устойчивы к действию слабых кислот и щелочей, а также к нагреванию до 60 °С.
Структурная единица AT - мономер - молекула цилиндрической формы, состоящая из двух идентичных тяжёлых Н-цепей [от англ. heavy, тяжёлый] и двух идентичных лёгких L-цепей [от англ. light лёгкий]. Тяжёлые и лёгкие цепи Ig состоят из аминокислотных остатков и соединены дисульфидными (-S-S-) связями. В цепях различают вариабельную область, или V-область [от англ. various, разный], и константную область, или С-область [от англ. constant, постоянный]. V-область у разных AT варьирует. V-области L- и Н-цепей образуют Аг-связывающий центр (активный центр AT, паратоп), или Fab-фрагмент [от англ. fragment фрагмент, + antigen binding, связывающий Аг]. Константная область молекулы называется Fc-фрагмент [от англ. fragment crystallizable, фрагмент кристализации].
В месте соединения Fab- и Fc-фрагментов расположена шарнирная область, позволяющая Аг-связывающим фрагментам разворачиваться для более тесного контакта с Аг.
Область молекулы антител (Fab) определяет антигенную специфичность, а Fc осуществляет эффекторные функции.
Fab-фрагменты антитела взаимодействуют с антигенными детерминантами. Аг-связывающий центр комплементарен эпитопу Аг (принцип ключ-замок). Связывание Аг с AT нековалентно и обратимо. Аффинность (сродство) Аг к антителу определяется физико-химическими свойствами взаимодействующих молекул и соотношением концентраций связанных и свободных Аг и антител. На сродство влияют пространственное соответствие взаимодействующих участков молекул, электростатические, гидрофобные взаимодействия и силы Ван дер Ваальса.
Авидность - интегральная характеристика силы связи между Аг и AT, учитывающая взаимодействие всех активных центров с эпитопами Аг.
Валентность антитела - число активных (Аг-связывающих) центров антитела. Молекула полного Ig как минимум двухвалентна. Такие антитела известны как полные антитела; мономеры с меньшей валентностью - неполные антитела.
Полные антитела (в частности, IgM, IgG) вызывают агрегацию Аг, видимую невооружённым глазом (например, РА бактерий).
Неполные антитела содержат один Аг-связывающий центр и, поэтому, одновалентны (например, антитела, вырабатываемые при бруцеллёзе). Второй Аг-связывающий центр у подобных Ig экранирован различными структурами либо обладает низкой авидностью.
Неполные антитела функционально дефектны, так как не способны агрегировать Аг. Неполные AT могут связывать эпитопы Аг, препятствуя контакту с ними полных антител; поэтому их также называют блокирующими антителами .
Fc-фрагмент антитела
Константные участки тяжёлых цепей определяют характер взаимодействий антитела с клетками и молекулами иммунной системы, в частности специфичность связывания молекулы Ig с клетками-эффекторами (например, фагоцитами, тучными клетками), несущими на своей поверхности рецепторы к Fc-фрагменту.
Fc-фрагмент определяет также эффекторные функции антитела (например, активацию комплемента). Для реализации этих свойств сразу после связывания Аг Fab-фрагментами происходят конформационные изменения структуры Fc-фрагментов. Пространственно изменённые Fc-фрагменты распознают фагоциты, именно они способствуют фиксации С1а-компонента комплемента и запуску комплементарного каскада по классическому пути. В противном случае ни клетки, ни эффекторные молекулы были бы не в состоянии отличить интактные AT или антитела, связавшие Аг.
Взаимодействие антител с антигеном включает специфическую и неспецифическую фазы.
Специфическая фаза протекает быстро и представляет специфическое взаимодействие активного центра с Аг.
Неспецифическая фаза протекает медленнее, зависит от присутствия электролитов и свойств Аг. Корпускулярные Аг агрегируются в крупнодисперсные конгломераты и выпадают в осадок (феномен агглютинации).
Растворимые Аг образуют мелкодисперсные конгломераты (феномен преципитации), проявляющиеся помутнением раствора или образованием колец преципитации либо зон преципитации в гелях.
Константные участки лёгких цепей бывают двух типов - каппа (к) и ламбда; константные участи тяжёлых цепей представлены пятью основными формами - мю (р), гамма (у), дельта (8), альфа (а) и эпсилон (е). Каждая из них ассоциирована с отдельным классом Ig. Выделяют 5 классов AT: IgA, IgD, IgE, IgG и IgM .
Молекулы IgG, IgD и IgE представлены мономерами, IgM - пентамерами; молекулы IgA в сыворотке крови - мономеры, а в экскретируемых жидкостях (слёзная жидкость, слюна, секреты слизистых оболочек) - димеры.
IgM синтезируются при первичном попадании Аг в организм. Пик образования приходится на 4-5-е сутки с последующим снижением титра. Образование IgM к некоторым Аг (например, жгутиковым Аг бактерий) осуществляется постоянно. К IgM относят значительную часть AT, вырабатывающихся к Аг грамотрицательных бактерий.
Наличие IgM к Аг конкретного возбудителя указывает на острый инфекционный процесс.
Молекула IgM - пентамер; пять субъединиц соединены J-цепью [от англ. joining, связывающий], в результате чего молекула IgM приобретает 10 Аг-связывающих участков.
Молекулы IgM опсонизируют, агглютинируют, преципитируют и лизируют содержащие Аг структуры, а также активируют систему комплемента по классическому пути (для комплементзависимого лизиса бактерии достаточно одной молекулы IgM).
Иммуноглобулин G (IgG) - основной класс AT (до 75% всех Ig), защищающий организм от бактерий, вирусов и токсинов. После первичного контакта с Аг синтез IgM обычно сменяется образованием IgG.
Максимальные титры IgG при первичном ответе наблюдают на 6-8-е сутки. Обнаружение высоких титров IgG к Аг конкретного возбудителя указывает на то, что организм находится на стадии реконвалесценции или конкретное заболевание перенесено недавно. В особо больших количествах IgG синтезируется при вторичном ответе.
IgG представлены 4 подклассами: IgG1, IgG2, IgG3 и IgG4; их относительное содержание (в %) составляет соответственно 66-70, 23, 7-8 и 2-4. IgG непосредственно участвуют в реакциях иммунного цитолиза, реакциях нейтрализации, а также усиливают фагоцитоз, действуя как опсонины и связывая рецепторы Fc-фрагмента в мембране фагоцитирующих клеток (в результате этого фагоциты эффективнее поглощают и лизируют микроорганизмы).
Только IgG способны проникать через плаценту, что обеспечивает формирование у плода пассивного иммунитета.
Иммуноглобулины А (IgA) циркулируют в сыворотке крови (составляет 15-20% от всех Ig), а также секретируются на поверхность эпителия. Присутствуют в слюне, слёзной жидкости, молоке и на поверхности слизистых оболочек.
AT класса IgА усиливают защитные свойства слизистых оболочек пищеварительного тракта, дыхательных, половых и мочевыделительных путей. В сыворотке крови IgA циркулируют в виде двухвалентных мономеров; в секретируемых жидкостях преобладают четырёхвалентные димеры, содержащие одну J-цепь и дополнительную полипептидную молекулу (синтезируемый эпителиальными клетками секреторный компонент).
Эта молекула присоединяется к мономерам IgA в ходе их транспорта через эпителиальные клетки на поверхность слизистых оболочек. Секреторный компонент участвует не только в связывании молекул IgA, но обеспечивает их внутриклеточный транспорт и выделение на поверхность слизистых, а также защищает IgA от переваривания протеолитическими ферментами.
Молекулы IgA участвуют в реакциях нейтрализации и агглютинации возбудителей. Кроме того, после образования комплекса Аг-АТ они участвуют в активации комплемента по альтернативному пути.
Иммуноглобулин Е (IgE) специфически взаимодействуют с тучными клетками и базофильными лейкоцитами, содержащими многочисленные гранулы с БАВ. Их выделение из клетки (дегрануляция) вызывает резкое расширение просвета венул и увеличение проницаемости их стенки. Подобную картину можно наблюдать при аллергических реакциях (например, бронхиальной астме, аллергическом рините, крапивнице).
Аг-связывающие Fab-фрагменты молекулы IgE специфически взаимодействуют с Аг, попавшим в организм. Сформированный иммунный комплекс взаимодействует с рецепторами Fc-фрагментов IgE, встроенных в клеточную мембрану базофила или тучной клетки. Это взаимодействие и является сигналом для дегрануляции с высвобождением гистамина и других БАВ и развёртыванием острой аллергической реакции.